出品:科普中国
作者:要乐 刘芸(中国科学院南京地质古生物研究所)
监制:中国科普博览
珊瑚礁在全球海洋环境中扮演着重要角色,是海洋中最大的生态系统,被称为海洋中的“热带雨林”(Bouchet, 2006)。珊瑚礁可以为海洋动物提供庇护之所,目前已知约有10万个物种栖息其中(Reaka-Kudla, 1997;Plaisance et al., 2011)。此外,珊瑚礁的附属生物也为人类提供了食物和药物资源,地球上有100多个国家和超过4.5亿人口的生活与珊瑚礁息息相关(Pandolfi et al., 2011)。
然而,当今海洋珊瑚礁的生存现状却不容乐观。人类到底该怎样保护日益退化的珊瑚礁?科学家们从3.3亿年前的造礁珊瑚身上找到了答案。
海洋珊瑚礁生存现状
近年来,全球气候变暖和人类活动,导致了降雨增加、陆地冰川消融加快、陆地化学风化作用增强、营养元素向海洋输入增加等现象发生,进而使得海水富营养化、浑浊度上升、缺氧和酸化程度加剧,造成了海洋造礁珊瑚的死亡和珊瑚礁系统的崩溃。
除了人为因素引起的海洋环境污染,陆源碎屑输入这一自然因素也对海洋珊瑚礁造成了严重影响,其常常伴随着造礁珊瑚的死亡或形态变化。
陆源碎屑,指的是陆地上岩石风化后形成的碎屑物质,比如砂质、黏土等,其成分较为复杂,主要以硅(Si)、铝(Al)元素富集为特征。在降雨、植物繁盛等因素的影响下,陆地风化作用增强,陆源碎屑输入也进一步增加,致使海洋中营养元素含量增加。尽管当今人为排放也会造成海水富营养化,但这种影响在地质时期并无法体现,而陆源碎屑输入的影响则早已存在,且横亘古今。
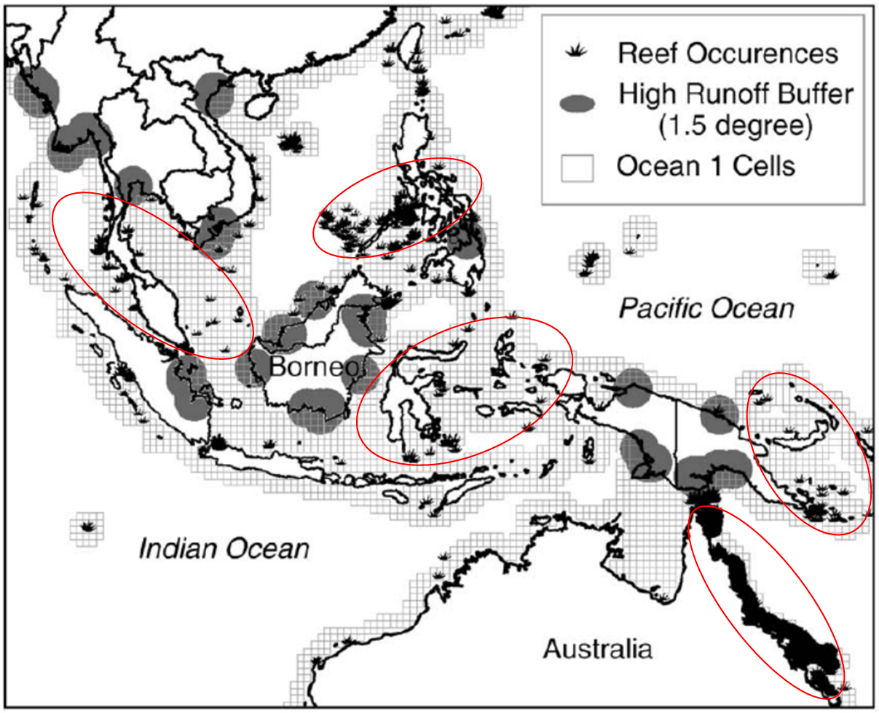
图1. 东南亚和澳大利亚地区陆源碎屑输入与造礁珊瑚间的相互关系
(图片来源:McLaughlin et al., 2003)
地质历史时期珊瑚礁的演变
地质历史时期也曾发生过陆源碎屑输入增加的现象,但目前关于造礁珊瑚面对陆源碎屑输入如何响应的认识尚未明晰。所谓造礁珊瑚,是指在海洋大陆架上发育的可以原位叠加生长的珊瑚,它们可以在海底形成具有正向隆起地貌的珊瑚格架岩石,也就是珊瑚礁。
密西西比亚纪中-晚期(维宪期-谢尔普霍夫期)陆地植物繁盛,还发生了显著的海西造山运动,这两者共同促使该时期陆地化学风化作用加强、陆源碎屑和营养物质输入增加,进而导致全球气候急剧变冷和海平面降低。
晚古生代大冰期是显生宙持续时间最长的冰期,由一系列多幕式冰期-间冰期组成,以南半球冈瓦纳大陆发育冰川沉积为特征。最新研究发现,在维宪晚期(Asbian-Brigantian之交),腕足类壳体氧同位素发生了一次显著正偏,指示该时期古海水温度明显降低,这可能代表了晚古生代大冰期主幕的开始。同时,海洋珊瑚礁系统也发生了崩溃,并伴随着底栖生物多样性的降低(Yao et al., 2022)。
因此,对密西西比亚纪中-晚期造礁珊瑚的形态大小进行研究,可以为当今陆源碎屑输入影响下造礁珊瑚的演变趋势提供新认识。
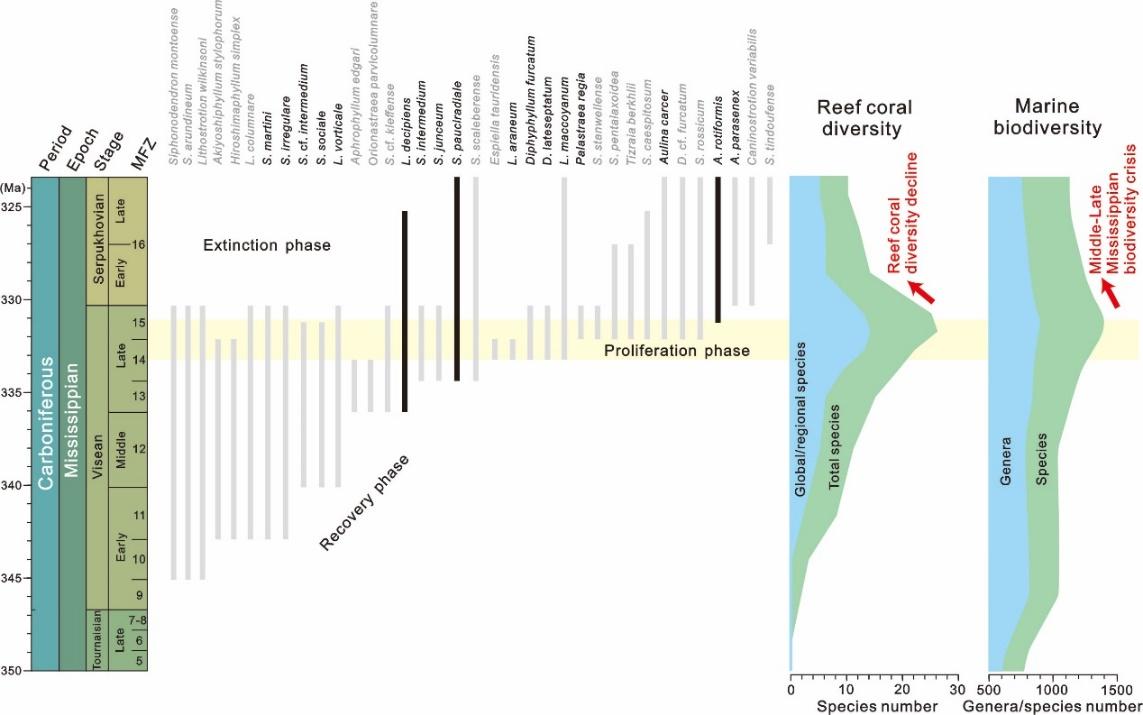
图2. 密西西比亚纪海洋造礁珊瑚与总体生物的多样性变化和演化模式
(图片来源:南京古生物所)
深时造礁珊瑚研究
近期,中国科学院南京地质古生物研究所晚古生代研究团队副研究员要乐和助理研究员林巍,与法国图卢兹第三大学教授Markus Aretz、美国南加州大学教授David J. Bottjer、以及南京大学教授王向东合作,对密西西比亚纪中-晚期造礁珊瑚的形态大小和陆源碎屑输入等问题进行了系统研究。
研究团队对我国贵州雅水、湖南马栏边、安徽王家村和内蒙古尖山子四条不同沉积相剖面谢尔普霍夫期全球广布的造礁珊瑚化石Aulina rotiformis和Lithostrotion decipiens的个体大小参数(单骸直径、横板带直径和隔壁数)进行了统计,并对造礁珊瑚和围岩进行了元素含量研究,相关研究成果发表在英国《皇家学会会刊B辑》(Proceedings of the Royal Society B)。
研究发现,雅水剖面珊瑚个体最大,尖山子剖面珊瑚个体最小,Aulina rotiformis和Lithostrotion decipiens的横板带直径则分别减少了31%和23%。
其中,雅水剖面向尖山子剖面珊瑚个体逐渐变小的原因,可能与陆源碎屑输入增加有关——碎屑物质覆盖珊瑚虫表面,可能会使其直接死亡,或是需要其消耗额外的能量来清除碎屑物,从而造成供给珊瑚生长的能量减少,进一步导致珊瑚个体变小。
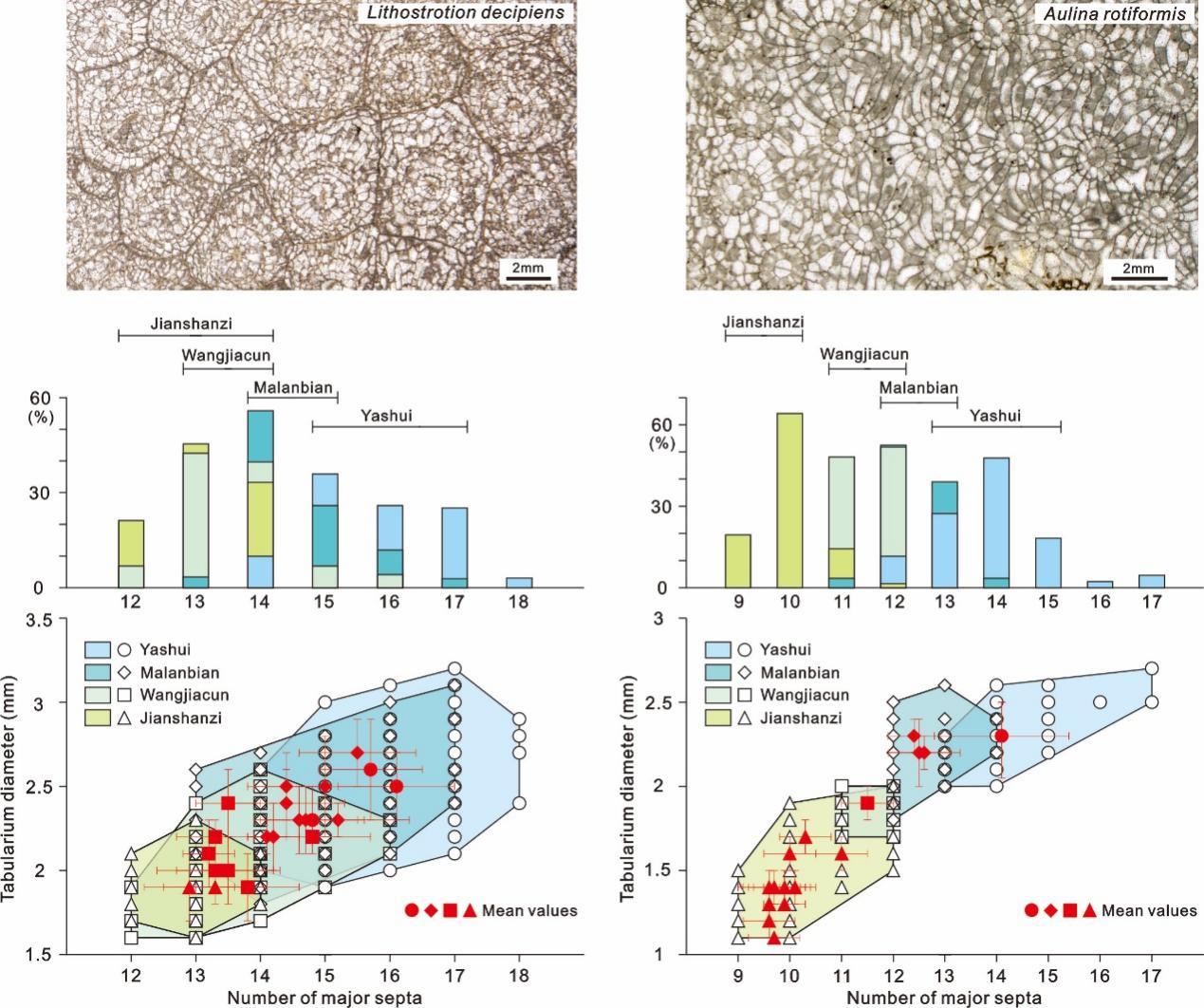
图3. 密西西比亚纪晚期不同沉积相剖面造礁珊瑚Lithostrotion decipiens和Aulina rotiformis的单骸直径、横板带直径和隔壁数的变化
(图片来源:南京古生物所)
团队成员还对珊瑚Lithostrotion decipiens的埋藏特征进行了研究,发现雅水剖面向王家村剖面Lithostrotion decipiens的个体保存逐渐变差,珊瑚围岩中陆源碎屑(泥质和石英质)含量逐渐增加,并伴随硅(Si)、铝(Al)、磷(P)元素含量的增加,王家村剖面珊瑚围岩中含有丰富微生物、缺少后生动物发育。
微生物的呼吸作用会导致缺氧和环境酸化,从而遏制珊瑚生长。结合雅水剖面向王家村剖面珊瑚个体逐渐变小的现象和珊瑚围岩碎屑含量的变化来看,可以发现陆源碎屑输入是控制珊瑚个体变小的主要原因。

图4. 密西西比亚纪晚期不同沉积相剖面造礁珊瑚Lithostrotion decipiens及其围岩的微相和元素分布特征
(图片来源:南京古生物所)
此外,研究结果还显示,在谢尔普霍夫期,空间上从华南板块的浅水开阔碳酸盐岩相、碳酸盐岩-碎屑岩过度相、到浅水碎屑岩相,造礁珊瑚个体逐渐变小,而珊瑚围岩中Si、Al、P元素含量明显增加。
在长尺度上,基于中国、西欧和北非地区密西西比亚纪中-晚期造礁珊瑚Lithostrotion decipiens和Siphonodendron pauciradiale的个体大小数据,可以发现造礁珊瑚个体在维宪晚期(Asbian-Brigantian之交)明显减小,这与晚古生代冰期主幕开始时伴随的陆地风化作用增强和陆源碎屑输入增加相一致。

图5. 密西西比亚纪中-晚期造礁珊瑚Lithostrotion decipiens和Siphonodendron pauciradiale的形态大小变化与该时期陆源输入、海水表层温度、低纬度海平面和中-高纬度冰川记录的关系
(图片来源:南京古生物所)
现代海洋造礁珊瑚对陆源碎屑的响应
科研人员从当今的澳大利亚大堡礁中采集了直径大于20 cm的丛状复体珊瑚Acropora tenuis、A. millepora和Pocillopora acuta,然后将它们移植到了户外的水流系统,使其保持与海洋珊瑚礁相似的生活环境(如水温27℃、文石基底、共生珊瑚藻等),并在其中饲养珊瑚幼虫。
在实验中,科研人员选取了3-6个月大的三种珊瑚,并将其分别暴露于4种悬浮沉积物含量(0, 10, 30 or 100 mg l−1)和营养物质含量不同的水体中,进行了为期40天的珊瑚生长观察(图6)。
实验结果显示,悬浮沉积物大大降低了A. millepora的存活率,且A. millepora的幼体死亡数量与沉积物浓度成正比。此外,尽管A. tenuis和P. acuta的幼体数量并没有发生显著减少的现象,但它们的幼体生长大小却减少到一半以下或停止生长(图7)。

图6. 当今海洋珊瑚Acropora tenuis、A. millepora和Pocillopora acuta在不同悬浮沉积物含量水体中的生存状态
(图片来源:Humanes et al., 2017)
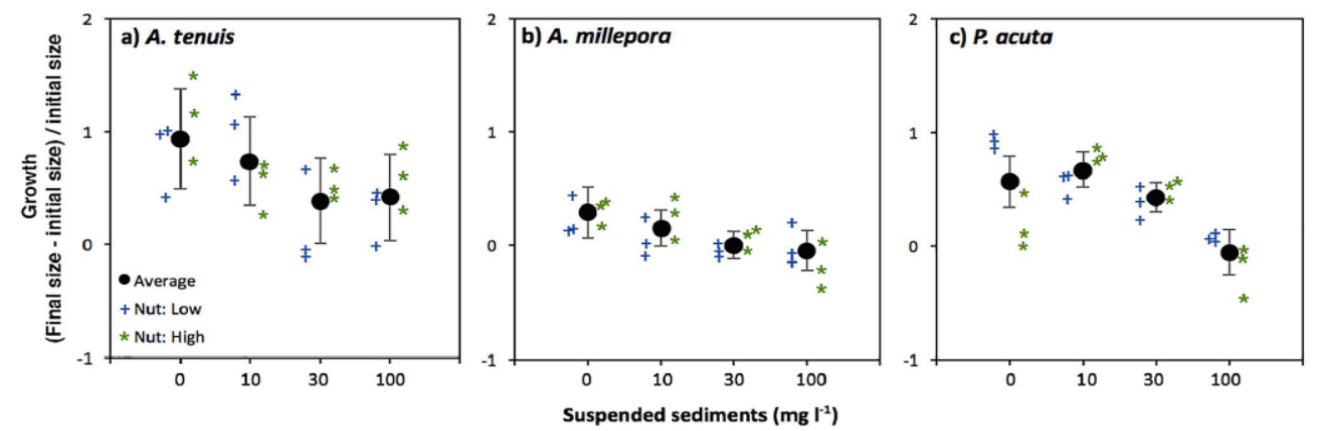
图7. 三种珊瑚实验幼体生长大小与沉积物含量的相互关系图
(图片来源:Humanes et al., 2017)
由此可以看出,一些珊瑚物种的幼体暴露在悬浮沉积物中是有能量代价的,而这就意味着沉积物输入的增加会对特定物种种群和造礁珊瑚的生长产生一定影响(Humanes et al., 2017)。
当陆源碎屑输入增加时,珊瑚用于呼吸、清除沉积物和修复生态环境等活动的能量消耗也会随之增加。并且,有机质会使沉积物形成大颗粒,进一步增加珊瑚的能量消耗。此外,营养物质增加会促使微生物繁盛,而其代谢的有机质,会在局部地区形成不利于珊瑚的生存的缺氧和酸性环境。上述的诸多因素,都会导致珊瑚生长缓慢或发生死亡。
对当今海洋珊瑚礁保护的启示
晚古生代大冰期,是地球上自动植物繁盛以来唯一一个与现代大气二氧化碳浓度相近的时期。因此,对晚古生代大冰期海洋生物-演化进行研究,可以为探索当今海洋生态系统的演变提供借鉴和启示。
通过对距今约3.3亿前造礁珊瑚形态大小变化及其对陆源碎屑输入响应的系统研究,学者们从时空上揭示了晚古生代大冰期起始、陆源碎屑和营养物质输入增加导致造礁珊瑚个体变小的演化趋势。
面对晚古生代大冰期陆源碎屑输入和古环境的变化,部分珊瑚惨遭灭绝,但还有一些珊瑚克服恶化的环境生存了下来,这是为什么呢?
研究发现,这些战胜环境变化的珊瑚,可能具有较强的表型可塑性,即面对环境变化,它们可以通过改变自身个体大小来更好地适应新的环境状态。也就是说,3.3亿年前生存下来的造礁珊瑚,可以通过将个体变小来适应晚古生代大冰期伴随的古环境变化。
另外,该研究从长尺度生物演化方面为当今海洋珊瑚礁的保护措施和未来发展趋势提供了启示:具有较强表型可塑性的造礁珊瑚,可能更加适应当今陆源碎屑输入、水体缺氧等环境变化。因此,在未来珊瑚礁保护方面,应避免只重视数量和速度的“创可贴”式修复,优先选择具有较强表型可塑性的造礁珊瑚进行修复,从而实现对当今海洋中最大的生态系统——珊瑚礁的高质量保护。
(注:该研究得到国家自然科学基金委、中国科学院青年创新促进会和中国科学院战略性先导科技专项(B类)的联合资助。)
编辑:马怡群
参考文献:
[1] Bouchet P (2006). The magnitude of marine biodiversity. In: Duarte CM, editor. The exploration of marine biodiversity: scientific and technological challenges. Bilbao, Spain: Fundación BBVA. pp. 31–64.
[2] Reaka-Kudla M (1997). The global biodiversity of coral reefs: a comparison with rain forests. In: Reaka-Kudla M, Wilson DE, Wilson EO, editors. Biodiversity II: understanding and protecting our biological resources. Washington, D.C.: Joseph Henry Press. pp. 83–108.
[3] Plaisance L, Caley MJ, Brainard RE, Knowlton N. (2011). The diversity of coral reefs: what are we missing? PLoS ONE 6, e25026.
[4] Pandolfi, J. M. et al. (2011). Projecting coral reef futures under global warming and ocean acidification. Science 333, 418–422.
[5] Mclaughlin, C. J. , Smith, C. A. , Buddemeier, R. W. , Bartley, J. D. , & B.A. Maxwell. (2003). Rivers, runoff, and reefs. Global & Planetary Change, 39(1-2), 191-199.
[6] Humanes A, Fink A, Willis BL, Fabricius KE, Beer DD, Negri AP. (2017). Effects of suspended sediments and nutrient enrichment on juvenile corals. Mar. Pollut. Bull. 125, 166–175.
[7] Yao, L*., Lin, W., Aretz, M., Bottjer, D.J., Wang, X.D., (2023). Colonial coral resilience by decreasing size: reaction to increased detrital influx during onset of the late Palaeozoic Ice Age. Proc. R. Soc. B, 290, 20230220. https://doi.org/10.1098/rspb.2023.0220.
(注:文中拉丁文部分应为斜体。)








 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国