出品:科普中国
作者:黎茵(中山大学生命科学学院)
监制:中国科普博览
植物以固着的生活方式生存,绝大多数的植物都是安安静静的,不会自己发生运动。
不过,有些植物在特殊情况下确实可以产生明显可观察到的运动,比如含羞草叶片被触碰后的收拢和下垂、捕虫植物捕捉器的闭合运动等等。

捕蝇草叶片的闭合运动
(图片来源:参考文献[1])
动物会利用可收缩的肌肉来改变身体的形状并产生运动。而驱动植物运动的主要原理,是通过细胞吸水或者失水,依赖流体静力和渗透压使一些组织层中的细胞膨胀或收缩,从而引起器官发生可逆的大幅度形状变化。这类细胞称为运动细胞(motor cell),在渗透压变化时膨胀(或收缩)从而产生运动。但是人们对其中精细的细胞机制却知之甚少。

动物肌肉的收缩运动与植物细胞的吸水膨胀运动
(图片来源:参考文献[3])
那植物为什么要进行运动?它们到底是如何运动的呢?
收缩细胞:斑叶唇柱苣苔的运动秘密
最近,中国科学院植物研究所王印政团队在斑叶唇柱苣苔(Chirita pumila)的研究中有了新的发现,为植物运动器官内部的细胞机制提供了新的解析。
斑叶唇柱苣苔是苦苣苔科唇柱苣苔属的一年生草本植物,其花朵的柱头具有运动特性。研究团队在野外观察时就发现,这种植物的柱头可以产生呈双向开合-弯曲的运动,柱头具有水敏性,而且其运动具有昼夜节律特征。
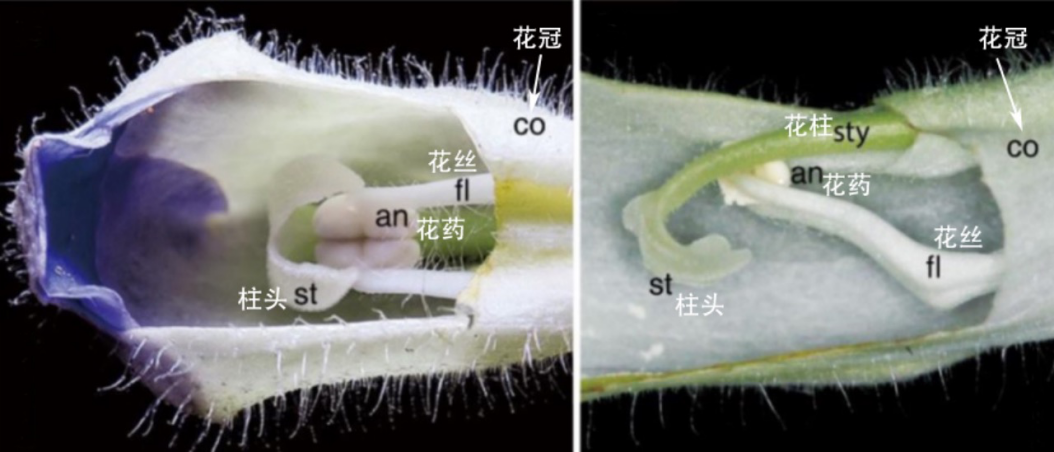
斑叶唇柱苣苔花蕾的解剖图
(图片来源:参考文献[6])
研究团队在对斑叶唇柱苣苔解剖分析后发现,当其柱头吸水时,柱头上有一类成层分布的细胞在吸水后会大幅度伸长,伸长长度可达细胞原长度的8倍以上。
这种细胞占据了柱头片层一半的体积,与柱头的伸长-收缩运动密切相关,因此将其命名为“收缩细胞”(contractile cells)。收缩细胞能随着日夜湿度的变化而发生可逆的伸长和收缩变化,驱动柱头产生昼夜节律运动。
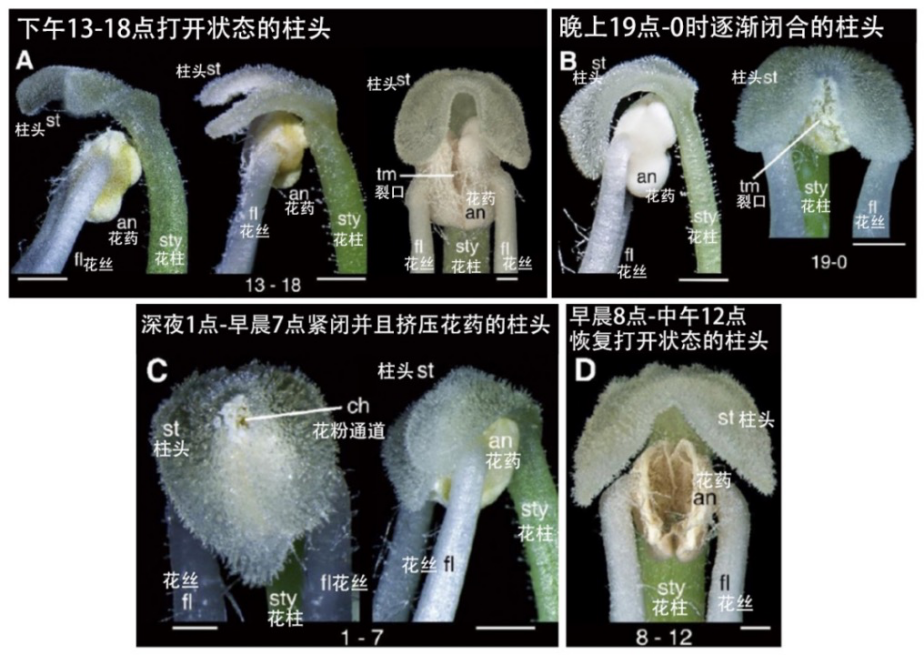
柱头的昼夜运动
(图片来源:参考文献[6])
研究团队在冷冻电子显微镜下观察发现,收缩细胞属于一种新的细胞类型。细胞内充满网状结构,细胞核被挤至边缘。这种细胞不具有薄壁细胞那样的中央大液泡。
充满细胞的网状结构是水敏性的粗面内质网(内质网是高等生物细胞内由一层单位膜所形成的囊状、泡状和管状结构,并形成一个连续的网膜系统,内质网膜外表面有核糖体附着的称为粗面内质网)。收缩细胞内的粗面内质网可以通过吸水膨胀推动收缩细胞伸长,从而导致柱头运动。这种特殊形式的粗面内质网也是第一次被发现。
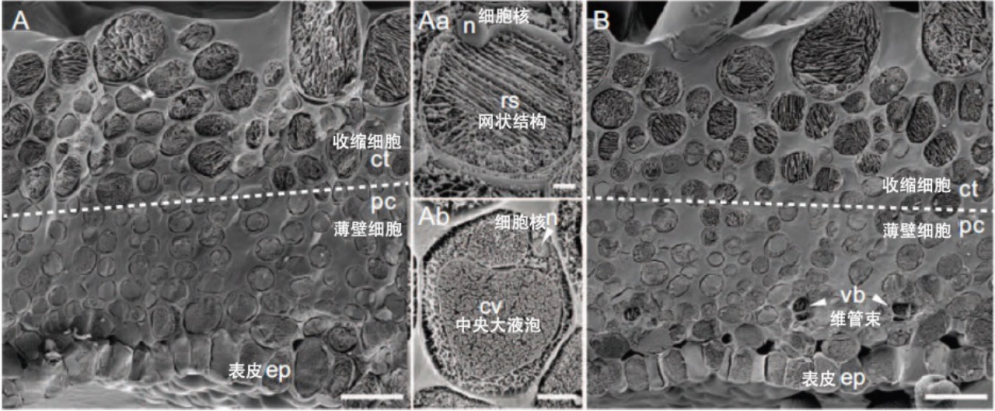
冷冻电镜下收缩细胞与薄壁细胞的比较
(图片来源:参考文献[6])
为何要动?独特的生殖保障策略
斑叶唇柱苣苔与同属的其他物种一样,花器官的形态适合昆虫进行异花授粉,类似的结构在很多植物中存在,有利于促进昆虫授粉并防止自交,以便维持其遗传多样性。
在这类结构中,两个隆起并且面对面粘着的花药,位于弯曲的柱头片层背面与花柱之间的位置,使得向下延伸的柱头授粉上表面远离花药,这是一种典型的抗自交结构,使得花朵中的花粉难以接触到自身花柱的授粉表面。
然而,斑叶唇柱苣苔是一个例外,它通常在开花前就在花蕾中完成自花授粉。
根据观察结果发现,柱头和花药同步早熟,其自花授粉过程与柱头对花药的机械挤压也同步。当柱头片层持续对花药施加机械压力时,花药被挤压变形,大量的花粉很可能被强行从花粉通道中排出。

柱头片层在水敏性实验中遇水闭合并弯曲
(视频来源:参考文献[6])
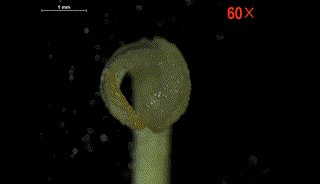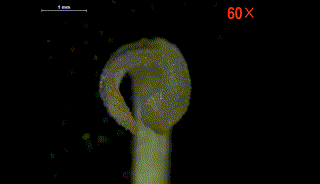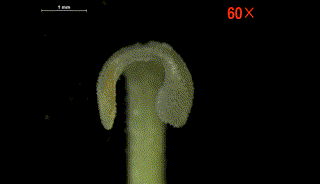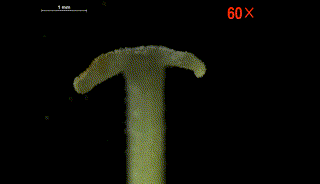
柱头片层随着水分流失逐渐恢复原状
(视频来源:参考文献[6])
这种柱头运动方式非常特殊,两个柱头裂片之间会留有一个连接花药裂口的花粉通道。当柱头片层弯曲时持续挤压花药,花粉经过该通道直接喷射出来,散布到柱头的授粉表面上,从而完成自花授粉。
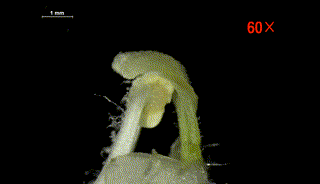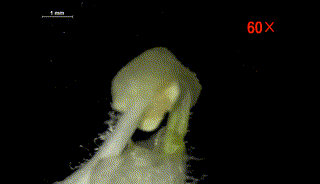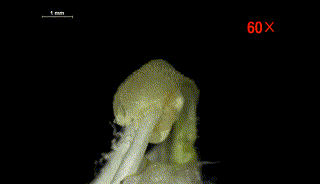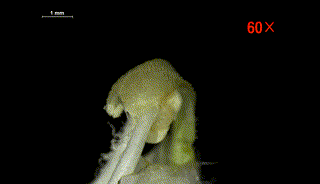
柱头水敏性实验侧面观
(图片来源:参考文献[6])

柱头运动的3D模型
(图片来源:参考文献[6])
由此看来,这种柱头开合-弯曲运动将原本的异花传粉转变为严格的开花前自花传粉,即闭花受精。
这是植物适应传粉环境不确定性的一种独特的生殖保障策略。在高湿度环境限制了传粉昆虫活动的情况下,仍可保证自行完成自交授粉过程。
进一步的基因表达分析显示,这些细胞中所表达的基因也不同于薄壁细胞。尤其是在柱头发育成熟的后期,收缩细胞中的基因表达特异性更为明显,检测到很多内质网、膜信号传导以及免疫反应等相关基因的表达与薄壁细胞差别显著。
这种可反复的闭合-弯曲柱头运动,对植物的有性繁殖具有功能方面的意义。研究团队希望,在未来能够揭示这种新的细胞类型是如何起源的,尤其是其起源的分子机制和进化过程,以及这种专门的繁殖策略是否也发生在开花植物的其他谱系中。
结语
正如人类会利用各种技术来保证自己长久的生存一样,植物也会采取各种各样的策略来适应环境的变化。也正是在这种与环境相互适应的过程中,大自然的物种才得以一直丰富而多样。
参考文献:
[1] Dumais J and Forterre Y. Annu Rev Fluid Mech, 2012, 44: 453–78.
[2] Liu BL, et al. Plant Cell Tiss Organ Cult, 2014, 118: 357–71
[3] Mano H and Hasebe M. J Plant Res, 2021, 134: 3–17.
[4] Morris RJ and Blyth M. J Exp Bot, 2019, 70: 3549–60.
[5] Sachse R, et al. Proc Natl Acad Sci USA, 2020, 117: 16035–42.
[6] Wang Y-Z, et al. Natl Sci Rev, 2023, 10: nwad208.






 2023-09-12
2023-09-12


 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国