导语
上期我们主要科普了遗传与基因。本期,我们主要聊一聊基因编辑技术,包括基因编辑技术的发展历程、分类、原理以及大家关注的问题,比如基因编辑技术的应用等。
本期我们邀请了上海巴斯德研究所研究员晁彦杰老师。晁老师在博士期间曾参与过诺奖成果的奠基性实验,发表了20余篇高影响力的论文,被引用次数超过6000次,是这个领域的“学术新星”。
01 基因编辑技术的发展历程
叶水送:基因决定着我们的性状。很多科学家一直在思考,当基因出了问题,我们应当如何修理呢?晁老师,您能分享一下基因编辑技术的发展历程吗?
晁彦杰:基因编辑技术其实已经有了较长的历史。在CRISPR/Cas9问世之前,已经有很多科学研究工作在实验室中进行了。
在这之前,尤其是在低等生物中,如大肠杆菌或者酵母,有很多的尝试和工具的开发,但是效率并不高,也远远无法达到在人体中应用的程度。
第一代是较大的锌指核酸酶,效率非常低。第二代为转录激活因子样效应因子核酸酶。
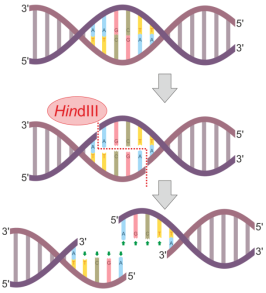
在CRISPR开始之前,最有用、最高效的一代就是“锌指蛋白”基因编辑工具,(这个工具)利用蛋白质来识别DNA或进行基因编辑。虽然准确性很高,但效率还是很低。直到近10年前,CRISPR/Cas9的发明才有了最新一代的基因编辑技术。
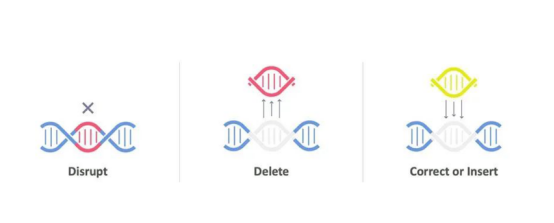
因为CRISPR/Cas9的发现,基因编辑技术的效率被提升到一个非常高的水平,可以真正应用于人体研究、哺乳动物的研究,甚至可以应用于临床上的研究和治疗。
此前,基因编辑技术已经有了比较长的历史和铺垫。直到近年来,CRISPR/Cas9的发现实现了新的突破,因此它成为了一项“明星技术”。
02 CRISPR/Cas9技术原理
叶水送:2012年CRISPR/Cas9技术问世后,很多人关注“为何这个技术会产生如此大的影响”,您能介绍一下这个技术的原理吗?
晁彦杰:CRISPR/Cas9技术的问世实际上可以归功于2012年Jennifer Doudna和Emmanuelle Charpentier在《Science》上发表的一篇论文。

Emmanuelle Charpentier

Jennifer Doudna
这两位女科学家证明了在体外或大肠杆菌中能够进行基因编辑,为科学界提供了一种全新的技术,之后这个技术引起了很多人的关注。
然而,后来张锋和George Church两位科学家相继在《Science》上发表了两篇论文,首次使用CRISPR/Cas9技术在人类细胞或哺乳动物细胞中进行大规模的基因编辑。这实际上是技术的真正应用,因而引起了更多人的关注。

华人学者张锋
这项技术之所以产生如此大的影响,也是因为它在很短的时间内(几个月或不到一年的时间)就能够在人类细胞中实现高效且大规模的基因编辑。这让人们看到了基因编辑技术应用的巨大潜力和价值。
这项技术的原理是使用了一种新型的核酸酶,即Cas9蛋白质。
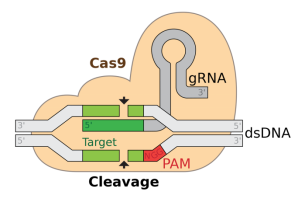
这个核酸酶具有一个特点,那就是它不能随意切割,而是必须依赖一个核酸作为导引。这个导引就是CRISPR或guide RNA。当这个RNA和蛋白质组成一个复合体时,它可以引导蛋白质准确地切割特定的位点。
只有这样,基因编辑才能够实现高效且准确的特性,从而达到潜在的临床治疗应用。因此,可以说是Doudna和Charpentier开创了这个领域的先河。
03 CRISPR/Cas9技术的优势
叶水送:与其他基因编辑技术相比,CRISPR/Cas9这个技术有何优势,短板又在哪里?
晁彦杰:CRISPR/Cas9的优势非常多,它可以在最短的时间内就达到“一统天下”的局面,主要就在于它简便、可行、高效。CRISPR/Cas9的向导使用一段核酸或RNA,这个RNA有无限的可能性,可以在体外合成,并且合成效率非常高,成本却很低。
它可以在几天内合成成千上万个向导,可以对无数个位点、任何一个人体基因、任何一个物种的基因进行编辑。这种技术的高效性是任何一种方法都无法比拟的。
同时,CRISPR/Cas9的时间和经济成本都非常低,可以在短短的几天之内合成向导RNA,在哺乳动物细胞中完成编辑,而且编辑效率非常高,可以在短时间内粗略筛选,拿到编辑后的细胞和产物。
另外一个优势是,CRISPR/Cas9可以同时编辑很多个基因。由于向导RNA可以无限组合,可以使用多个向导RNA,同时在一个细胞内靶向多个基因。这个优势也是其他方法无可比拟的。
有优势自然也有短板。在临床中,CRISPR/Cas9的短板就在于编辑有一定的脱靶效应,不是在100%位点完成想要的编辑,这个是所有编辑技术存在的问题。
虽然有这些短板,但目前技术开发人员也在尝试着去提高这项技术,很多科学家都在不断地优化、开发这项技术。
04 CRISPR/Cas9的开创者
叶水送:我们知道您当时也与诺奖得主Emmanuelle Charpentier有些合作,甚至在她的几篇开山之作里面也有您的署名。您能分享一下这项技术几位开创者的故事吗?Charpentier在发表《Science》论文之前在做一些什么工作,**有没有像现在一样受到这么多关注?
晁彦杰:我对诺奖得主Emmanuelle Charpentier是相当熟悉的。我们同属于“原核RNA生物学”这一个较小的领域,在她成功之前,她就和我们实验室开始了合作。

其实,最开始发现CRISPR/Cas9的文章就是由我参与合作的文章。

晁彦杰研究员名字位列其中

在她因这篇文章成名之前,她还是一个职务较低的课题组长,她在维也纳艰难地带领自己的课题组。
当时她就有一个比较感兴趣的一个方向,就是在病原细菌中的链球菌,她希望在链球菌中能发现一些新型的非编码小RNA。
后来她和我们实验室展开了合作,我们实验室有着RS测序(单分子实时测序)的技术和非编码小RNA的研究基础。然后,我们就在她病原细菌的物种中发现了非编码小RNA。
当时完全是兴趣驱动着这项基础研究工作,我们完全没有想到这工作能够发表在《Nature》上面,亦或者是能够产生CRISPR/Cas9这样一项改变世界的重大研究。
当时,我们尽我们所能为这份工作做实验,发现在链球菌中有一个新型的非编码小RNA。很巧的是,这个小RNA是跟CRISPR相关的,而且是跟CRISPR/Cas9相互作用的。
因为这份工作,Charpentier的学术发展也变得非常顺利。她离开了维也纳大学,去瑞典建立了一个新的实验室,后来又回到了德国建立了更大的实验室。在这个过程中,我们都是有沟通的。
现在Charpentier仍然在病原细菌的RNA生物学领域做着非常出色的工作,并在柏林马普研究所创立了一个新的研究单元。
05 华人学者的主要贡献
叶水送:所以说,一个原始创新的技术在诞生之前往往也是比较艰难的。兴趣是最好的老师,我们知道华人科学家在这个领域做出了非常重要的贡献,比方说张锋,他也因此获得了盖尔德纳奖等重要奖项,**您能介绍一下他和其他几位华人学者在这个领域的主要贡献吗?
晁彦杰:实际上,我们华人科学家在这个领域做出了非常大的贡献,尤其是在国内生命科学的发展和壮大方面,在这个领域中,我们华人的贡献得到了体现。

其中代表就是张锋,他一直涉足基因编辑这个领域。在CRISPR/Cas9被发现之前,他就已经在美国从事基因编辑工作,应该是在丘奇实验室。他利用锌指蛋白进行基因编辑。
当CRISPR/Cas9出现的那一刻,甚至是在文章进行的过程中,他听到了CRISPR/Cas9这个工具,就觉得非常感兴趣,非常震撼,认为这是未来的方向。因此,他可能是全世界最早涉足CRISPR研究的科学家之一。
然后,也正是因为这样子,当Doudna和Charpentier于2012年在《Science》发表文章之后,他们在一年以内就已经利用这些工具实现了在哺乳动物细胞中的基因编辑。
所以,张锋可以说是CRISPR/Cas9应用的先驱科学家。在此之后,他不仅仅有了这一项工作或者一个应用抢了第一个第一,而是在此之后一系列的工作在这个领域生根,做出了很多新的贡献。比如说,Charpentier和Doudna,利用了CRISPR/Cas9这一个蛋白质可以基因编辑。但是张锋认为,这一类的蛋白应该有很多,在自然界中有各种各样的生物多样性,可以有其他更好、更高效、更有应用价值的蛋白质。
然后,他就跟美国NCBI做生物信息学基因发掘的一个人合作,在各种各样难以培养的微生物中发现了许多功能特异的Cas蛋白质。然后,利用这些Cas蛋白质,发现了更多的基因编辑技术或者更精细的编辑技术。不光是能够做基因编辑,他发现也可以做基因诊断或者检测。
06 国内基因编辑领域优秀的工作
叶水送:晁老师,您能简单地说一下国内这个领域中有哪些亮点的工作吗?

晁彦杰:国内的其实有很多做得非常优秀的科学家代表。我们国家在农业方面的应用利用CRISPR/Cas9去改造动植物,动物养殖有几个农业院校做得比较好。在猴子中也做出了基因编辑,为临床研究或者是疾病研究提供了很多的模型。
另外,北京大学有些学者能够在疾病治疗里面利用CRISPR,比如尝试治疗HIV或者是传染性疾病,也做出了非常好的贡献。
07 基因编辑技术的优化
叶水送:目前,CRISPR/Cas9基因编辑人类脱靶的一些可能性,还有一些AAV载体的递送、免疫源性等问题,您觉得这个技术未来如果应用于临床,哪些环节还需要进行优化?
晁彦杰:我觉得递送系统是一个需要优化的地方,因为CRISPR/Cas9仍然是一种细菌来源的物质,或者是一种人体外源的物质。把CRISPR/Cas9递送到人体细胞中去,在理想的组织细胞中进行理想的编辑,这中间是需要一些过程的。
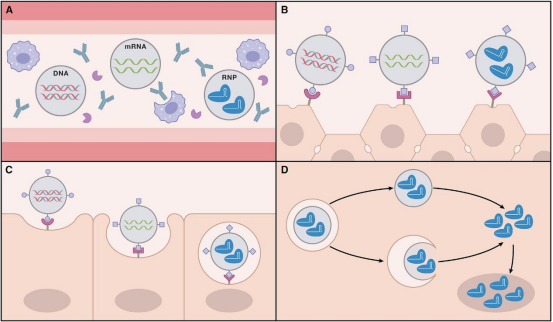
目前的应用仅仅存在于局部的编辑,尤其是视网膜、视神经疾病。这是一种采取局部注射到眼球细胞中去进行编辑。这样并不能应用于所有类型的疾病,比如血液病,只能是把血细胞提取出来,然后在体外进行编辑,重新输回到体内。
所以,真正能够让CRISPR/Cas9任意地在理想的器官、细胞中进行编辑,还需要进行递送的相关研究,能够让它达到靶向性地进入到理想的目标细胞中去。
另外一种就是基因脱靶。这个研究已经是世界上所有的科学家都在努力的方向。作为一个人体治疗或者是基因编辑的工具,如果有任何脱靶的现象发生,都会整合到人体的基因组中去,然后会遗传到这个人的下一代、下下一代,会永久地存在于人体的基因史中,所以说,潜在的脱靶可能性影响会是非常深远的。
现在世界上所有从事这个领域的科学家们都希望能够进一步优化基因编辑的效率和准确性。
08 未来基因编辑如何发展
叶水送:您觉得未来基因治疗发展方向是怎样的?
晁彦杰:从事生物学的人都会去欣赏或者是去理解自然的多样性,这些不同工具的问世其实都是一种生物技术的发展。每一种工具都有它们最理想或者是最适合的应用场景。

我不觉得基因治疗未来就会被其他治疗所代替,反而我们应该去思考的是有哪些疾病、哪些特定的场景必须使用基因治疗来完成。我能想到的是一些罕见病或者遗传病的研究,因为这些疾病是由于DNA的缺陷或者基因组的缺陷导致的。所以,在DNA水平上进行编辑能够达到一次编辑就能完全解决问题,这个是基因治疗没有办法被替代的,是它最适合的治疗场景。
然后,mRNA疫苗、蛋白降解实验仍然是一种正在发展中的技术。虽然它在新冠过程中作为疫苗使用的先例,但是它仍然还不够成熟,尤其是遗传病治疗中。
至于它们最适用什么场景或者解决什么问题,还是有待进一步研究的。
本文为科普中国·星空计划扶持作品
团队/作者:深究科学
审核:陶宁 中科院生物物理所 副研究员
出品:中国科协科普部
监制:中国科学技术出版社有限公司、北京中科星河文化传媒有限公司






 2023-09-26
2023-09-26

 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国