近日,中国科学院合肥物质院强磁场中心王俊峰研究员课题组基于对人源铁蛋白分子结构的深入理解,依托稳态强磁场实验装置,成功开发了新型热敏感型铁蛋白突变体,实现了化疗药物阿霉素的简便高效装载,相关成果发表在国际期刊International Journal of Biological Macromolecules上。
人源铁蛋白可以通过自组装形成均一稳定的纳米笼,在过去的几十年里,利用这种独特的天然靶向能力和纳米笼结构,人源铁蛋白已经被广泛用于药物分子、成像剂、核酸等的装载,并用于多种疾病的诊断和治疗。然而,目前已提出的铁蛋白药物装载策略步骤复杂,反应条件较为苛刻(如高温、强酸/碱等),导致药物装载率和蛋白质回收率较低,限制了铁蛋白纳米药物的临床应用。
在本研究中,通过对铁蛋白表面八个三相亲水通道和六个四相疏水通道结构的深入分析,研究团队成功预测了铁蛋白四相通道结构域与热敏性之间的关联。在此基础上,研究团队构建了一种新型的高效热敏感型铁蛋白突变体(Ecut-HFn),通过结合铜离子的辅助作用,成功实现了低温条件下的一步法药物装载。这种新型的铁蛋白药物装载策略具有以下优点:1. 整个封装过程在相对温和的条件下进行(45 ℃),无需使用酸/碱试剂或其他变性剂,也无需高温处理,经济环保。这意味着它适用于装载一些不耐受酸碱和高温条件的药物或食品中的生物活性成分。2. 铁蛋白的壳状结构保持完整,几乎没有涉及到蛋白的解聚,因此蛋白质回收率较高(蛋白回收率约90%),且仍保留了铁蛋白天然的肿瘤靶向能力。3. 药物装载效率明显提高(约110个阿霉素/蛋白笼)。
该研究不仅深入揭示了铁蛋白四相通道结构域与热敏性的构效关系,而且为拓展基于人源铁蛋白结构改造的新型药物装载方式提供了重要思路。
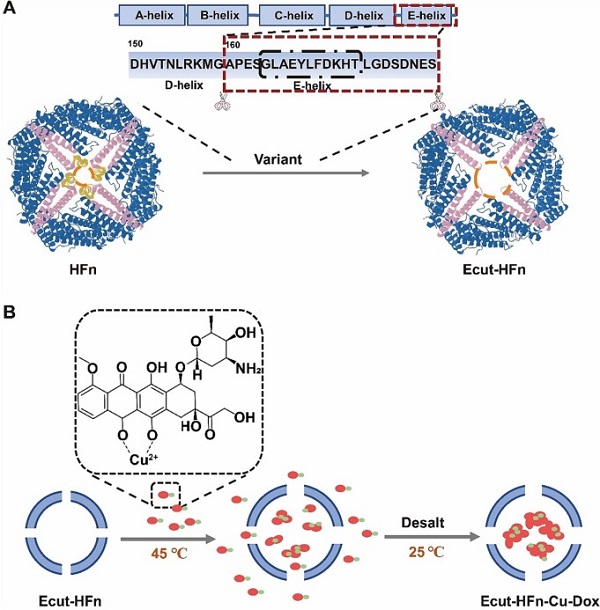
图. 铜离子辅助Ecut-HFn热响应载药示意图





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国