我校生命科学与医学部许超教授、张凯铭教授与以色列巴伊兰大学Itay Koren教授合作,揭示了CRL2APPBP2E3泛素连接酶识别底物羧基端降解信号(C-degron)的分子机制,相关成果以“Molecular basis for C-degron recognition by CRL2APPBP2ubiquitin ligase”为题于10月16日在线发表在《PNAS》杂志上。
泛素-蛋白酶体系统(UPS)是真核细胞中的主要蛋白质降解通路,介导泛素化依赖的蛋白质降解,通过消除不需要或折叠错误的蛋白质,在蛋白质质量控制中发挥关键作用。在典型的E1-E2-E3泛素化级联反应通路中,泛素连接酶E3通过结合E2~泛素(E2~Ub)和底物,催化泛素从E2转移到底物特定的赖氨酸上。因此,E3决定了UPS的特异性。在大多数情况下,它可以直接识别底物蛋白质中的特定基序,这种基序被称为降解子(degron)。蛋白质暴露的羧基末端降解信号(C-degron),可以被Cullin-RING E3泛素连接酶(CRLs)复合体中不同的底物受体所识别,包括KLHDC2, FEM1A/1C, FEM1B以及APPBP2等。之前的工作中,许超教授课题组通过解析FEM1B、FEM1C与Arg/C-degron小肽的复合物晶体结构,揭示了CRL2FEM1通过识别Arg/C-degron调控蛋白质稳态的分子机制。而APPBP2作为CRL2的另一种底物受体,已被证明能识别底物羧基末端Arg-x-x-Gly基序(R-x-x-G/C-degron)并介导底物的降解,然而,其中的分子机制仍然是未知的。
研究人员体外纯化组装了CRL2APPBP2与三种不同R-x-x-G/C-degron小肽结合的复合物(图1),包括XP_211896(L-T-R-N-K-G-P)、XP_211896的变体(L-T-R-N-K-G-P-A-A)和MRPL28(Q-K-R-A-S-G-Q),通过冷冻电镜分别解析其原子分辨率结构。
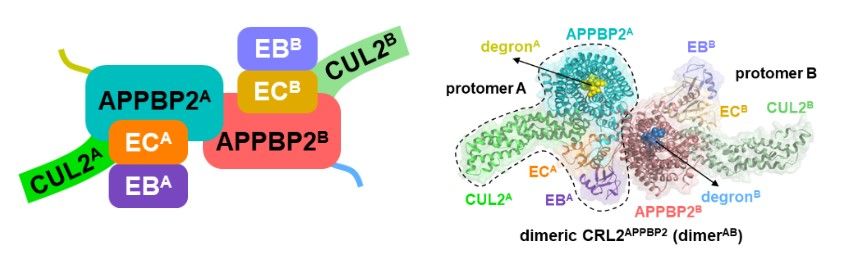
图1:CRL2APPBP2二聚体与R-x-x-G-P/C-degron复合物的冷冻电镜结构
结构分析表明,所有C-degron小肽结合在由APPBP2的TPR repeats 6-11所组成的一个深的口袋中,C-degron序列中的Gly和Arg分别被APPBP2口袋中的窄沟槽以及带负电的表面所识别(图2)。另外,APPBP2残基与XP_211896 C-degron的Arg-5、Asn-4和Lys-3的主链氢键网络赋予了-5RNKG-2基序刚性,从而阐明了C-degronArg和Gly之间需要间隔两个残基(R-x-x-G)的机理。此外,生物化学实验进一步表明R-x-x-G在C-degron序列中的位置具有一定可塑性,R-x-x-G羧基端加入1-3个残基不影响与APPBP2结合。
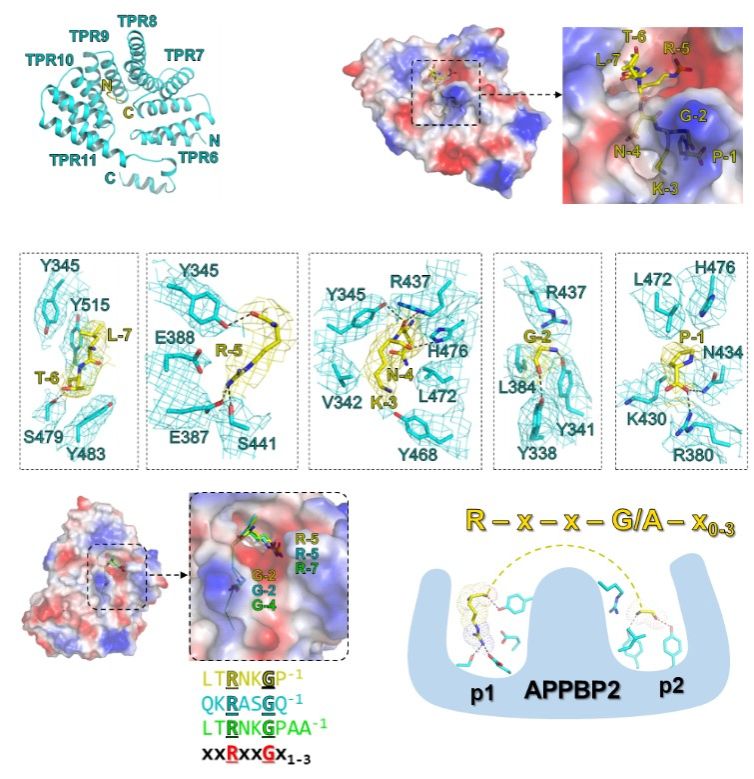
图2:APPBP2识别R-x-x-G/C-degron的分子机制
研究人员利用突变、等温滴定量热(ITC)实验验证APPBP2与R-x-x-G/C-degron作用界面,并进一步通过细胞内基于双荧光的蛋白质稳定性报告系统(GPS)揭示R-x-x-G/C-degron通过招募CRL2APPBP2介导绿色荧光蛋白质降解。以上研究不仅解析了CRL2APPBP2识别R-x-x-G/C-degron的分子机制,而且为未来设计靶向CRL2APPBP2的小分子抑制剂和PROTAC分子提供了基础。






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国