天然无序蛋白(intrinsically disorder protein, IDP)广泛存在于真核生物的蛋白质组中,并在遗传信息转录、信号转导等生命过程中发挥关键作用。如何对天然无序蛋白高度柔性和异质的构象进行高分辨刻画一直是该领域方法学发展中的重点问题。超过15%的IDP分子在细胞内处于膜结合状态,它们在磷脂双分子层环境下的内部及全局运动(internal and global motions)与其理化性质和生物功能息息相关,但这些动态过程难以通过常规结构分析方法进行捕获和定量表征。
近期,中国科学技术大学龙冬教授课题组发展了基于膜顺磁弛豫增强技术(mPRE)的IDP波谱分析方法,成功实现对膜结合IDP分子内部构象动态、膜内旋转及浸没深度的高精度建模。相关成果以“Quantitative Ensemble Interpretation of Membrane Paramagnetic Relaxation Enhancement (mPRE) for Studying Membrane-Associated Intrinsically Disordered Proteins”为题发表于著名学术期刊《美国化学会志》(Journal of the American Chemical Society)。
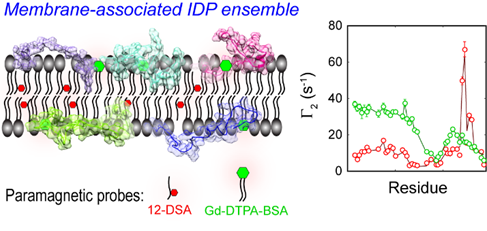
图1. 基于mPRE顺磁弛豫速率(Γ2)的膜结合态IDP系综建模。
在该工作中,研究人员为准确解释mPRE波谱数据,详细探究了自旋探针分子在膜内的柔性和流动性,并提出加权三维点阵模型用于定量刻画自旋探针动态性对膜顺磁弛豫增强速率(Γ2)的影响。利用该模型的计算高效性,研究人员进一步发展了mPRE实验数据引导的迭代更新算法,对膜结合天然无序蛋白的全局和内部运动自由度进行系统优化,实现了隐式膜环境下IDP全原子系综模型的构建。作为原理验证和应用示范,该方法被用于解析CD3ε胞质结构域(CD3εCD)在脂质双胶束(lipid bicelle)中的动力学系综。CD3εCD包含有重要的酪氨酸信号转导基序(ITAM),以固有无序状态与脂质双分子层形成模糊复合物(fuzzy complex),并利用膜对关键酪氨酸位点的动态屏蔽来调节其信号转导活性。基于mPRE实验参数生成的动力学系综在原子水平上详细绘制了CD3εCD在膜内不同区域的动态分布,并揭示ITAM上不同酪氨酸位点与膜作用的关键差异,为T细胞中起抑制反馈作用的ITAM单磷酸化(monophosphorylation)状态提供了新的机制性解释。该工作所确立的mPRE波谱分析方法预期可广泛推动各种功能性膜天然无序蛋白的原子分辨率研究。






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国