嗜黏蛋白阿克曼氏菌
Akkermansia muciniphila
疣微菌门 Verrucomicrobiota
疣微菌纲 Verrucomicrobiae
疣微菌目 Verrucomicrobiales
阿克曼氏菌科 Akkermansiaceae
阿克曼氏菌属 Akkermansia
嗜黏蛋白阿克曼氏菌(简称Akk菌)2004年从健康成人的粪便样本中被分离出来,是疣微菌门第一个种,目前阿克曼氏菌属也仅有3个种,分别是嗜黏蛋白阿克曼氏菌A. muciniphila、嗜聚糖阿克曼氏菌A. glycaniphila、琵琶湖阿克曼氏菌A. biwaensis。
随着科学发展和技术手段的进步,越来越多研究表明Akk菌在代谢类疾病、癌症和免疫治疗等方面具有独特功效,有望在微生物层面对抗疾病,成为下一代益生菌(NPGs)新星。今天带领大家回顾其研究历史,详细介绍其研究进展、应用情况和国内外保藏情况。
Akk菌的研究进展
Akk菌在初次发现后未受到关注,随着技术的发展,Akk菌(MucT)在2011年完成了全基因组测序并表明其与宿主代谢相关,2013年发现在患有肥胖/II型糖尿病老鼠的体内Akk数量急剧下降,之后的十年以来有大量的小鼠临床研究表明Akk对代谢指标与免疫治疗有影响,菌株的研究与应用随之迅速发展[2]。
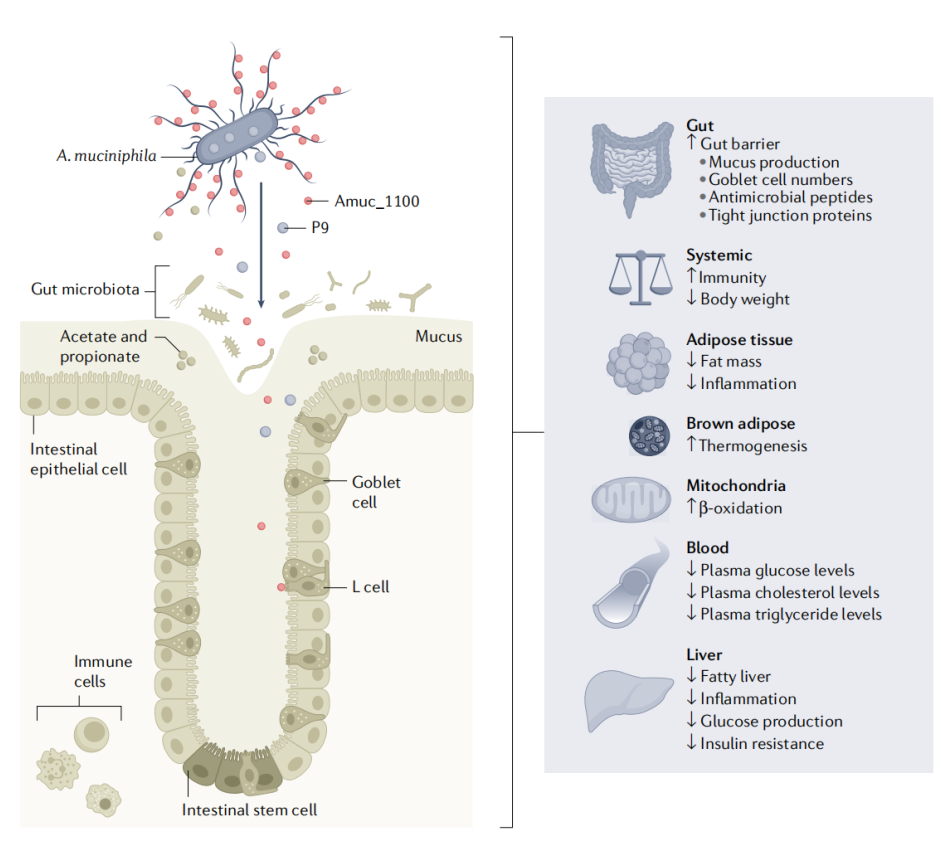
代谢健康背景下Akk对机体代谢的影响及主要作用因素[3]
1. 在代谢疾病方面
许多研究表明,相较于健康小鼠,代谢疾病模型小鼠肠道菌群中Akk丰度下降,在补充Akk后疾病小鼠相应症状得到有效改善[4]。
● 灌胃Akk可显著改善高脂饮食小鼠肠道粘膜屏障功能障碍和代谢紊乱的症状[5]。
● 在Ⅱ型糖尿病小鼠中,使用Akk与二甲双胍联合治疗可以增强二甲双胍的治疗效果[6],同时可以减少小鼠血液中内毒素含量并减轻小鼠肝损伤的症状[7]。
● 西方饮食小鼠补充Akk可预防小鼠动脉粥样硬化并减轻代谢性内毒素血症[8]。
2. 在神经退行性疾病方面
目前关于Akk调节脑功能方面有一些研究。对阿兹海默症模型小鼠灌胃Akk,可有效改善小鼠肠道屏障功能障碍、糖脂代谢紊乱,并通过降低脑内Aβ斑块沉积水平缓解认知障碍[9]。但补充Akk是否可以减轻帕金森病尚未得到一致性结论,其在帕金森病中的作用机制也尚不明确[10]。
3. 在癌症和免疫治疗方面
研究表明,肺癌小鼠使用Akk联合顺铂(CDDP) 治疗可缓解其肿瘤体积增长并改善肿瘤病理形态学变化,相较于CDDP单独治疗效果更佳,还可以增强免疫调节效果,成为未来治疗肺癌潜在方法[11]。此外,补充Akk可以增强免疫组断点疗法(ICB)对癌症的治疗效果,未来有望成为癌症临床治疗中的重要手段[12]。
4. 在肠道屏障和肠道炎症类疾病方面
关于Akk与肠道屏障功能及肠道疾病之间的关系一直以来都是医学研究的热点。人们发现在一些代谢疾病中补充Akk可以增加肠道黏液层厚度、调节紧密连接蛋白,恢复肠粘膜通透性,从而改善肠道屏障功能。
关于Akk与炎症性肠病之间的关系也备受关注。研究发现,在炎症性肠病患者粪便或肠道中,Akk的丰度普遍降低[13, 14]。而在葡聚糖硫酸钠(DSS)诱导结肠炎小鼠模型中,Akk灌胃可缓解小鼠黏膜炎症、保护肠道屏障和降低肠道中炎症因子水平,进而改善结肠炎[15]。因此,Akk在炎症性肠病的发展过程中起着潜在保护作用,肠道中Akk丰度降低可能是炎症性肠病(IBD)的潜在标志,补充Akk可以调节肠道生态失调、提高肠粘膜的屏障功能、降低血液和肠道中的炎症反应。
然而,Akk对IBD的调节作用仍存在争议,有研究表明其在IBD发展过程中起促炎作用[16],可能与宿主的基因型、肠道微生态环境特别是致病菌的种类和丰度有关[17]。因此,对于Akk与肠道屏障功能及肠道疾病之间的关系,我们需要更深入的研究来了解其作用机制和调节方式,以更好地预防和治疗炎症性肠病。
Akk菌的应用情况
Akk菌因其定植稳定、治疗效果广泛、且灭活后仍有功效的特点[4],在新型益生菌产品的研发上具有巨大优势,拥有很高的商业价值。
2022年欧盟委员会发布 (EU) 2022/168条例,根据欧洲议会和理事会关于新型食品的欧盟条例(EC)No 2015/2283建立欧盟新型食品清单,批准巴氏消毒法灭活的菌株作为新型食品投放欧盟市场。
Akk菌由“潜力”益生菌转变为真正的益生菌,还有许多实际问题需要解决:
研究表明,Akk菌在癌症、糖尿病、肥胖、早衰症、渐冻症、IBD、高血压、孤独症等多种疾病中具备潜在功能,在代谢调节和免疫治疗中具备良好应用潜力,是应用前景广阔的下一代益生菌及后生元前体菌种。目前,Akk菌发挥对应益生功效的作用机制有待进一步阐明,其量效关系还未有科学共识,不同剂量/丰度的Akk可能产生相悖结果。因此,Akk 菌在整个肠道生态系统中的作用机制及其与其他物种的协同互作关系,还有待深入研究和系统性解析,才能为该菌种在更广泛的人群应用和更多样的功能研发提供理论依据和技术支撑。
哪里保藏着Akk菌?
Akk菌对分离源、分离条件、培养条件和保藏方法等均要求严格,菌株丰度受年龄、种族、健康程度等多种情况影响,对底物有代谢偏好,仅利用黏蛋白作为碳源和氮源,且需严格厌氧条件,因此较难分离以及培养。
● 国际菌种保藏中心少量保藏,ATCC、DSM、JCM各保藏2株。
● 国内保藏中心仅CICC保藏1株**(CICC 24917)**,为Akkermansia muciniphila模式菌株,等同编号 ATCC BAA-835、DSM 22959、JCM 33894、CCUG 64013、BCRC 81048、CIP 107961。
那么,Akk菌特征特性有哪些?
2004年Derrien等人分离的Akk菌电镜图,记录了人类与Akk菌的初次相遇。
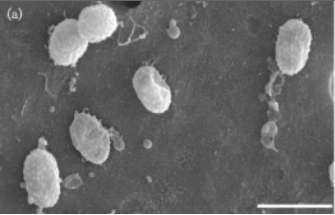
1 菌体呈椭圆形,单个或成对、极少呈链状。革兰氏阴性,不运动。
2 黏蛋白琼脂基础培养基上培养3 d后,菌落圆形、白色,直径为0.7 mm。
3 最适生长温度为 37°C,最适生长pH值为6.5,严格厌氧[1]。
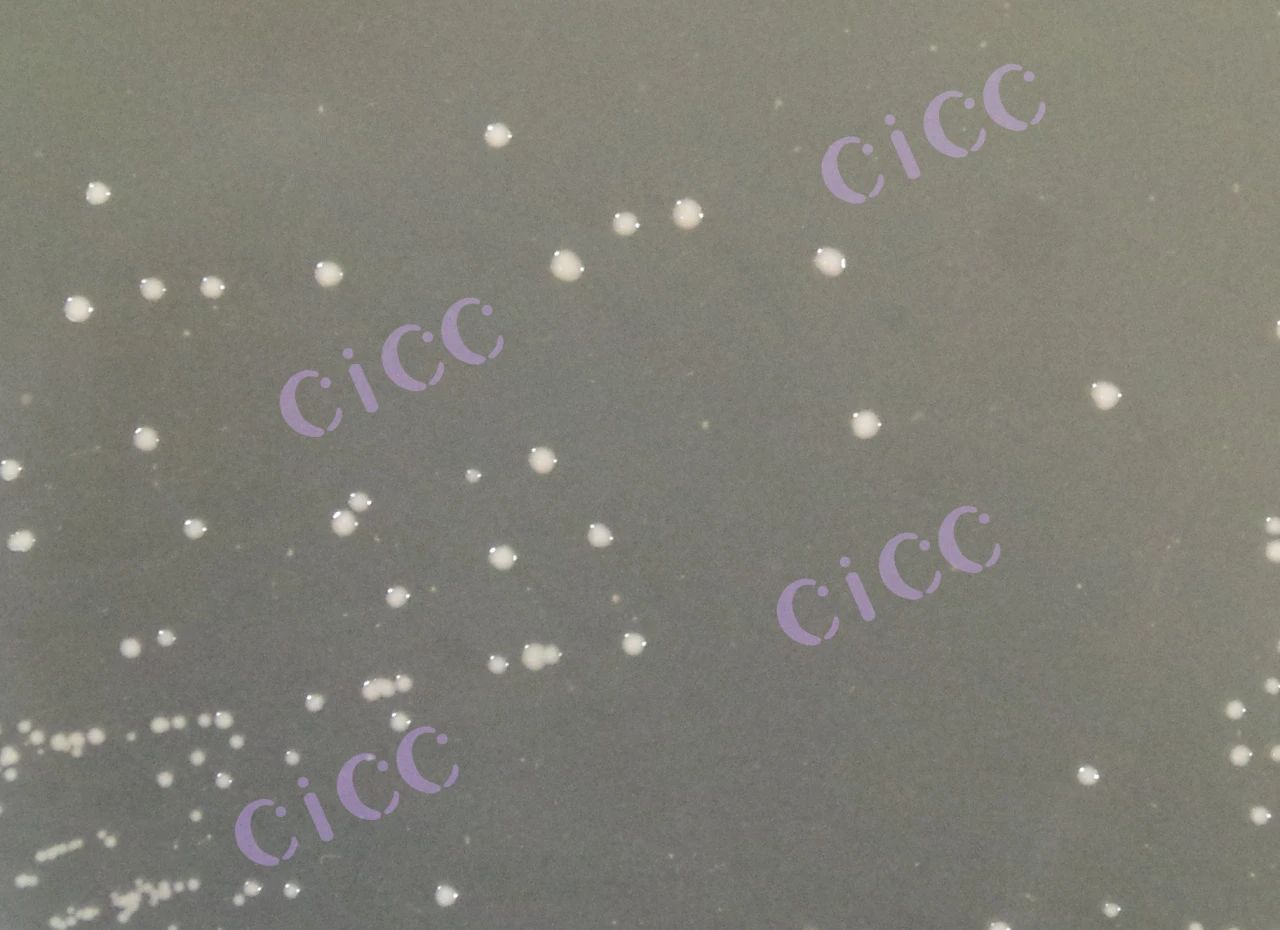
CICC 24917 菌落图片
**供稿单位:**中国工业微生物菌种保藏管理中心
中国工业微生物菌种保藏管理中心(CICC)负责全国工业微生物资源的收集、保藏、共享、鉴定、评价、研究开发和国际交流,在厌氧菌的分离、培养与保藏领域积累了丰富的经验,能够提供多种保藏形式的菌株,为菌种保藏技术开发和应用研究提供支撑。
参考文献
[1] Derrien M, Vaughan E E, Plugge C M, et al. Akkermansia muciniphila gen. nov.,sp. nov.,a human intestinal mucin degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology,2004,54( 5) : 1469-1476.
[2] Patrice D. Cani、Clara Depommier,et al.Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms[J].Nature Reviews Gastroenterology&Hepatology volume, 2022, 19,625–637
[3] Cani P D, Depommier C, Derrien M, et al. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms[J]. Nature Reviews Gastroenterology & Hepatology, 2022, 19(10): 625-637.
[4] Plovier H,Everard A,Druart C,et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice[J]. Nature Medicine,2017,23( 1) : 107-113.
[5] EVERARD A, BELZER C, GEURTS L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity [J]. Proceedings of the national academy of sciences, 2013, 110(22): 9066-71.
[6] Shin N R,Lee J C,Lee H Y,et al. An increase in the Akkermansia sp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice[J]. Gut,2014,63( 5) : 727-735.
[7] Everard A,Belzer C,Geurts L,et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controlsdiet-induced obesity[J]. Proceedings of the National Academy of Sciences,2013,110( 22) : 9066-9071.
[8] LI J, LIN S, VANHOUTTE P M, et al. Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in Apoe−/− mice [J]. Circulation, 2016, 133(24): 2434-46.
[9] OU Z, DENG L, LU Z, et al. Protective effects of Akkermansia muciniphila on cognitive deficits and amyloid pathology in a mouse model of Alzheimer’s disease [J]. Nutrition & diabetes, 2020, 10(1): 12.
[10] BI M, LIU C, WANG Y, et al. Therapeutic Prospect of New Probiotics in Neurodegenerative Diseases [J]. Microorganisms, 2023, 11(6): 1527.
[11] CHEN Z, QIAN X, CHEN S, et al. Akkermansia muciniphila enhances the antitumor effect of cisplatin in lewis lung cancer mice [J]. Journal of Immunology Research, 2020, 2020.
[12] ZHANG T, LI Q, CHENG L, et al. Akkermansia muciniphila is a promising probiotic [J]. Microbial biotechnology, 2019, 12(6): 1109-25.
[13] PNG C W, LINDéN S K, GILSHENAN K S, et al. Mucolytic bacteria with increased prevalence in IBD mucosa augmentin vitroutilization of mucin by other bacteria [J]. Official journal of the American College of Gastroenterology| ACG, 2010, 105(11): 2420-8.
[14] EARLEY H, LENNON G, BALFE Á, et al. The abundance of Akkermansia muciniphila and its relationship with sulphated colonic mucins in health and ulcerative colitis [J]. Scientific reports, 2019, 9(1): 1-9.
[15] BIAN X, WU W, YANG L, et al. Administration of Akkermansia muciniphila ameliorates dextran sulfate sodium-induced ulcerative colitis in mice [J]. Frontiers in microbiology, 2019, 10: 2259.
[16] WANG F, CAI K, XIAO Q, et al. Akkermansia muciniphila administration exacerbated the development of colitis-associated colorectal cancer in mice [J]. Journal of Cancer, 2022, 13(1): 124.
[17] ZHENG M, HAN R, YUAN Y, et al. The role of Akkermansia muciniphila in inflammatory bowel disease: Current knowledge and perspectives [J]. Front Immunol, 2023, 13: 1089600.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国