形成方式
1.组成分子里原子个数不同,如:氧气(O₂)和臭氧(O₃)。
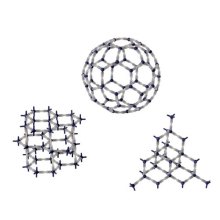
2.晶体,如:金刚石 (正四面体空间网状结构的原子晶体)、石墨(层状结构的混合型晶体)和C₆₀(存在单个分子的分子晶体)。
3.晶体里分子的排列方式不同,如:斜方硫和单斜硫。
物理与化学性质
同素异形体之间的性质差异主要表现在物理性质上,性质差异的原因是结构不同。同素异形体之间的转化属于化学变化,但不属于氧化还原反应。例如氧气是没有颜色、没有气味的气体,而臭氧是淡蓝色、有鱼腥味的气体;氧气的沸点为-183℃,而臭氧的沸点为-112.4℃。
同素异形体的化学性质相似但也存在差异。以熟知的金刚石与石墨为例,金刚石每个碳原子与相邻的四个碳原子以共价键连接,形成四面体结构,是一种原子晶体。而石墨中,碳原子呈层状排列,每一层的碳原子以共价键连接形成平面六边形,因此相对稳定,但层与层只见仅依靠微弱的分子间作用力连接,易发生相对滑动,因此石墨的化学性质与金刚石相比更为活泼,物理性质差异更加明显,金刚石是无色透明的晶体,熔点与硬度远大于石墨。而石墨是深灰色、质软、不透明,易导电的片状固体。臭氧的氧化性就比氧气要强很多。比如臭氧能将银氧化成正二价,能与钾反应生成臭氧化钾,这些都是氧气做不到的4。

相互转化
在大气平流层的25km处,存在一厚度为20km臭氧层,臭氧浓度可达10ppm。在臭氧层中,存在O2和O3相互转化的动态平衡:O2⇌O3。在转化过程中吸收了大量的紫外线,所以,臭氧层是地球上生物免遭紫外线伤害的自然屏障。 .
早在上个世纪30年代,就已经开始有石墨转化为金刚石的工业生产。目前,制得的金刚石虽达不到宝石级,但满足工业生产的要求还是绰绰有余的。90年代后,由石墨制得C60等球状分子和碳纳米管及其化合物C60H60、C60F60及笼形的金属化合物。2004年英国科学家又成功地从石墨晶体中剥离出单层的石墨片,这种世界上最薄的材料具有优异的导电导热性和其他特殊的性质,必将在社会生产的各种领域大有作为。
同素异形体的相互转化有时也会给人类带来危害。最典型的例子是白锡在13.2℃时开始转化为灰锡,低温或已有少量灰锡时,这种转变加速。由于白锡是金属晶体,密度较大,而灰锡是金刚石型的原子晶体,密度较小,所以白锡在低温转化为灰锡时体积迅速膨胀,生成的灰锡呈粉末状,造成锡制品的损坏。在不明真相的年代,这种现象被称为“锡瘟”。1873年英国的斯科特率领的南极探险队由于用锡焊制的油桶在低温下发生“锡瘟”致使燃油泄漏而遇难。
相关示例
碳
碳的同素异形体有金刚石、石墨、富勒烯、碳纳米管、石墨烯和石墨炔;它们的不同性质是由微观结构的不同所决定的。
(1)金刚石
 金刚石呈正四面体空间网状立体结构,碳原子之间形成共价键。当切割或熔化时,需要克服碳原子之间的共价键,金刚石是自然界已经知道的物质中硬度最大的材料,它的熔点高。上等无瑕的金刚石晶莹剔透,折光性好,光彩夺目,是人们喜爱的饰品,也是尖端科技不可缺少的重要材料。颗粒较小、质量略为低劣的金刚石常用在普通工业方面,如用于制作仪器仪表轴承等精密元件、机械加工、地质钻探等。钻石在磨、锯、钻、抛光等加工工艺中,是切割石料、金属、陶瓷、玻璃等所不可缺少的;用金刚石钻头代替普通硬质合金钻头,可大大提高钻进速度,降低成本;镶嵌钻石的牙钻是牙科医生得心应手的工具;镶嵌钻石的眼科手术刀的刀口锋利光滑,即使用一千倍的显微镜也看不到一点缺陷,是摘除眼睛内白内障普遍使用的利器。金刚石在机械、电子、光学、传热、军事、航天航空、医学和化学领域有着广泛的应用前景。
金刚石呈正四面体空间网状立体结构,碳原子之间形成共价键。当切割或熔化时,需要克服碳原子之间的共价键,金刚石是自然界已经知道的物质中硬度最大的材料,它的熔点高。上等无瑕的金刚石晶莹剔透,折光性好,光彩夺目,是人们喜爱的饰品,也是尖端科技不可缺少的重要材料。颗粒较小、质量略为低劣的金刚石常用在普通工业方面,如用于制作仪器仪表轴承等精密元件、机械加工、地质钻探等。钻石在磨、锯、钻、抛光等加工工艺中,是切割石料、金属、陶瓷、玻璃等所不可缺少的;用金刚石钻头代替普通硬质合金钻头,可大大提高钻进速度,降低成本;镶嵌钻石的牙钻是牙科医生得心应手的工具;镶嵌钻石的眼科手术刀的刀口锋利光滑,即使用一千倍的显微镜也看不到一点缺陷,是摘除眼睛内白内障普遍使用的利器。金刚石在机械、电子、光学、传热、军事、航天航空、医学和化学领域有着广泛的应用前景。
(2)石墨
石墨是片层状结构,层内碳原子排列成平面六边形,每个碳原子以三个共价键与其它碳原子结合,同层中的离域电子可以在整层活动,层间碳原子以分子间作用力(范德华力)相结合。石墨是一种灰黑色、不透明、有金属光泽的晶体。天然石墨耐高温,热膨胀系数小,导热、导电性好,摩擦系数小。石墨被大量用来做电极、坩埚、电刷、润滑剂、铅笔等。具有层状结构的石墨在适当条件下使某些原子或基团插入层内与C原子结合成石墨层间化合物。这些插入化合物的性质基本上不改变石墨原有的层状结构,但片层间的距离增加,称为膨胀石墨,它具有天然石墨不具有的可绕性,回弹性等,可作为一种新型的工程材料,在石油化工、化肥、原子能、电子等领域广泛应用。
(3)富勒烯
富勒烯(Fullerene) 是单质碳被发现的第三种同素异形体。任何由碳一种元素组成,以球状,椭圆状,或管状结构存在的物质,都可以被叫做富勒烯,富勒烯指的是一类物质。富勒烯与石墨结构类似,但石墨的结构中只有六元环,而富勒烯中可能存在五元环。1985年Robert Curl等人制备出了C60。1989年,德国科学家Huffman和Kraetschmer的实验证实了C60的笼型结构,从此物理学家所发现的富勒烯被科学界推向一个崭新的研究阶段。富勒烯的结构和建筑师Fuller的代表作相似,所以称为富勒烯。
初步研究表明,富勒烯类化合物在抗HIV、酶活性抑制、切割DNA、光动力学治疗等方面有独特的功效。
**(4)**碳纳米管
碳纳米管作为一维纳米材料,重量轻,六边形结构连接完美,具有许多异常的力学、电学和化学性能。近些年随着碳纳米管及纳米材料研究的深入其广阔的应用前景也不断地展现出来。
碳纳米管,又名巴基管,是一种具有特殊结构(径向尺寸为纳米量级,轴向尺寸为微米量级,管子两端基本上都封口)的一维量子材料。碳纳米管主要由呈六边形排列的碳原子构成数层到数十层的同轴圆管。层与层之间保持固定的距离,约0.34nm,直径一般为2~20 nm。并且根据碳六边形沿轴向的不同取向可以将其分成锯齿形、扶手椅型和螺旋型三种。其中螺旋型的碳纳米管具有手性,而锯齿形和扶手椅型碳纳米管没有手性。
(5)石墨烯
石墨烯(Graphene)是由碳原子构成的只有一层原子厚度的二维晶体。2004年,英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁·诺沃肖洛夫,成功从石墨中分离出石墨烯,证实它可以单独存在,两人也因此共同获得2010年诺贝尔物理学奖。
在2015年硼墨烯发现之前,石墨烯既是最薄的材料,也是最强韧的材料,断裂强度比最好的钢材还要高200倍。同时它又有很好的弹性,拉伸幅度能达到自身尺寸的20%。它是目前自然界最薄、强度最高的材料,如果用一块面积1平方米的石墨烯做成吊床,本身重量不足1毫克便可以承受一只一千克的猫。
石墨烯目前最有潜力的应用是成为硅的替代品,制造超微型晶体管,用来生产未来的超级计算机。用石墨烯取代硅,计算机处理器的运行速度将会快数百倍。
另外,石墨烯几乎是完全透明的,只吸收2.3%的光。另一方面,它非常致密,即使是最小的气体原子(氢原子)也无法穿透。这些特征使得它非常适合作为透明电子产品的原料,如透明的触摸显示屏、发光板和太阳能电池板。
作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料,石墨烯被称为“黑金”,是“新材料之王”,科学家甚至预言石墨烯将“彻底改变21世纪”。极有可能掀起一场席卷全球的颠覆性新技术新产业革命。
(6)石墨炔
石墨炔,是继富勒烯、碳纳米管、石墨烯之后,一种新的全碳纳米结构材料,具有丰富的碳化学键、大的共轭体系、宽面间距、优良的化学稳定性,被誉为是最稳定的一种人工合成的二炔碳的同素异形体。由于其特殊的电子结构及类似硅优异的半导体性能,石墨炔有望可以广泛应用于电子、半导体以及新能源领域。研究表明,石墨炔是一种非常理想的储锂材料,且其独特的结构更有利于锂离子在面内和面外的扩散和传输,这样赋予其非常好的倍率性能,从实践证明石墨炔是一种非常有前景的储锂能源材料,科学家也预测它在新能源领域将产生非比寻常的影响。
氧
氧的同素异形体有氧气,臭氧,四聚氧,八聚氧。
(1)氧气
氧气,化学式O2,式量32.00,是无色无味的气体,也是氧元素最常见的单质形态。熔点为218.4℃,沸点为-183℃。液氧为天蓝色,固氧为蓝色晶体。且不易溶于水,1L水中可以溶解约30mL氧气。在空气中,氧气约占21% 。常温下不是很活泼,与许多物质都不易作用。但在高温下则很活泼,能与多种元素直接化合,这与氧原子的电负性仅次于氟有关。
(2)臭氧
臭氧(O₃)又称为超氧,是氧气(O₂)的同素异形体。在常温下,它是一种有特殊臭味的淡蓝色气体。臭氧主要存在于距地球表面20~35公里的同温层下部的臭氧层中。在常温常压下,稳定性较差,可自行分解为氧气。臭氧具有青草的味道,吸入少量对人体有益,吸入过量对人体健康有一定危害(不可燃,纯净物)。氧气通过电击可变为臭氧。
(3)四聚氧(又名过臭氧)
O4的预计构型为正四面体或者矩形,从两种构型中性分子O4,正一价分子O4+和负一价分子O4-的基态电子结构,并根据能量最低原则确定了各自的结构参数,从而得到了O4分子2种结构的基态总能量、一价电离能及电子亲合势能。O4与氧原子、普通氧分子O2和臭氧分子O3的计算结果比较,显示O4分子可以以正方形结构或正四面体结构形式存在,其中正方形结构更有可能是O4分子的真实空间结构。
四聚氧有极其猛烈的氧化性,其氧化性在单质中最强,远超氟气、二氟化氪和各类氟化氧等已知的超强氧化剂。可与绝大多数物质甚至部分稀有气体直接反应。近期甚至用O4与氩(Ar)直接化合制得了极不稳定的一氧化氩(ArO)。
(4)八聚氧(又名ε氧/红氧)
四聚氧的分子式是O₄,1924年,吉尔伯特·牛顿·路易斯首先预测了它的存在。1999年,科学家认为固态氧的ε相(压强大于10GPa下存在)中氧的存在形式为O₄。然而2006年时,X射线晶体学表明这种被称作ε氧或红氧的稳定相实际上是O8。
形成于正常大气压的54.36K(-218.79°C)以下。固态的氧气由于吸收红色光,像液氧一样,是浅蓝色透明物质。氧分子因它在分子磁化(molecular magnetization)上与晶体结构、电子排布、超导电性的关系而受到关注。氧分子是能承载磁矩的唯一的简单双原子分子(通常情况下纵使所有分子也只有少数能够如此)。它被认为是“受自旋控制(spin-controlled)”的晶体,并因此展现出不寻常的磁性规律。在极高压下,固氧从热绝缘材料变成金属的形态;而在极低温下,它甚至能变成超导体。对固氧的结构研究始于19世纪20年代,目前,已确定六种泾渭分明的晶体相。
磷
磷的同素异形体有多种,常见的有白磷、红磷。
(1)红磷
理化常数:
国标编号:41001
CAS号:7723-14-0
英文名称:Phosphorus red
别 名:赤磷
分子式:P
外观与性状:紫红色无定形粉末,无臭,具有金属光泽,暗处不发光。
分子量:123.90
蒸汽压:4357kPa(590℃)
熔 点:590℃(4357kPa)
溶解性:不溶于水、二硫化碳,微溶于无水乙醇,溶于碱液。
密 度:相对密度(水=1)2.20;相对密度(空气=1)4.77。
稳定性:稳定
危险标记:8(易燃固体)
主要用途:用于制造火柴、农药,及用于有机合成。
对环境的影响:
该物质对环境有害。
一、健康危害
侵入途径:吸入、食入、经皮吸收。健康危害:经常吸入此种粉尘,可引起慢性磷中毒。可致皮炎。
二、毒理学资料及环境行为
毒性:属低毒类。危险特性:遇明火、高热、摩擦或撞击有引起燃烧的危险。与氧化剂混合能形成有爆炸性的混合物。燃烧时放出有毒的刺激性烟雾。化学反应活性较高,与氟、氯等能发生剧烈的化学反应。燃烧(分解)产物:氧化磷、磷烷。
现场应急监测方法:
直接进水样气相色谱法。
实验室监测方法:
气相色谱法。
应急处理处置方法:
一、泄漏应急处理
隔离泄漏污染区,周围设警告标志,切断火源。建议应急处理人员戴好防毒面具,穿相应的工作服。用水润湿,使用无火花工具收集于干燥净洁有盖的容器中,倒至空旷的地方,干燥后即自行燃烧。如果大量泄漏,与有关技术部门联系,确定清除方法。
二、防护措施
呼吸系统防护:佩带防尘口罩。眼睛防护:必要时戴安全防护眼镜。身体防护:穿工作服。手防护:戴防护手套。其它:工作现场严禁吸烟。工作后,淋浴更衣。注意个人清洁卫生。
三、急救措施
皮肤接触:脱去污染的衣着,立即用清水彻底冲洗。就医。眼睛接触:立即提起眼睑,用流动清水或生理盐水冲洗至少15分钟。吸入:迅速脱离现场至空气新鲜处。必要时进行人工呼吸。就医。食入:误服者给充分漱口、饮水,就医。灭火方法:干粉、砂土。
(2)白磷
白磷是磷的一种同素异形体,分子是由四个磷原子构成的正四面体, 键角60°,化学式为P₄。为白色蜡状固体,遇光会逐渐变为淡黄色晶体(所以又称为黄磷),有大蒜的气味,有毒。着火点很低,能自燃,在空气中可以发光。白磷是一种易自燃的物质,其燃点为40 ℃,但因摩擦或缓慢氧化而产生的热量有可能使局部温度达到40 ℃而燃烧。因此,不能说气温在40 ℃以下白磷不会自燃。
白磷是一种有强毒的物质。人的中毒剂量为15mg,致死量为50mg。误服白磷后很快产生严重的胃肠道刺激腐蚀症状。大量摄入可因全身出血、呕血、便血和循环系统衰竭而死。若病人暂时得以存活,亦可由于肝、肾、心血管的功能不全而慢慢死去。皮肤被磷灼伤面积达7%以上时,可引起严重的急性溶血性贫血,以至死于急性肾功能衰竭。常期吸入磷蒸气,可导致气管炎、肺炎及严重的骨骼损害。
白磷的贮存:
由于白磷非常危险,因此不能将白磷露置于空气中。根据白磷不溶于水,且比水的密度大,可以将少量的白磷放入盛有冷水的广口试剂瓶中,并经常注意保持足够的水量。通过水的覆盖,既可以隔绝空气,又能防止白磷蒸气的逸出,同时还能保持白磷处于燃点之下。不常用的白磷可以贮存于封口的试剂瓶中,并埋入沙地里。
白磷的取用:
由于白磷的燃点低,人的手温就容易使它燃烧,所以取用白磷时必须用镊子去取,绝对不能用手指去接触,否则手就会被灼烧,造成疼痛难愈的灼伤。如果遇到大块白磷需要切割成小块时,必须把它放在盛有水的水槽中,用小刀在水面下切割,绝不能暴露在空气中进行,否则切割时摩擦产生的热也容易使白磷燃烧。
白磷的用途:
白磷虽然危险,但也有很多用途。
在工业上用白磷制备高纯度的磷酸。利用白磷易燃产生烟(P₂O₅)和雾(P₂O₅与水蒸气形成H₃PO₄),在军事上常用来制烟幕弹。还可用白磷制造红磷、三硫化四磷、有机磷酸酯、燃烧弹、杀鼠剂等。
在高压下,白磷可转变为黑磷,它具有层状网络结构,能导电,是磷的同素异形体中最稳定的。如果氧气不足,在潮湿情况下,白磷氧化很慢,并伴随有磷光现象。白磷可溶于热的浓碱溶液,生成磷化氢和次磷酸二氢盐;干燥的氯气与过量的磷反应生成三氯化磷,过量的氯气与磷反应生成五氯化磷。磷在充足的空气中燃烧可生成五氧化二磷,如果空气不足则生成三氧化二磷。
接触白磷的物品的处理
由于白磷的毒性大且易自燃,接触过白磷的实验用品必须进行适当的处理。所用的刀子和镊子要在通风厨中用酒精灯灼烧。擦过上述工具或用于吸干白磷的纸片不能丢在废纸篓里。也要在通风厨中烧掉。实验中用过的水槽要冲洗数遍。人接触白磷后的急救方法人的手接触到白磷后,要立即用水冲洗,然后用2%的CuSO₄溶液(或2%的AgNO₃溶液)轻抹,再用3%~5%的NaHCO₃溶液湿敷。禁止用油脂性的烧伤药膏。如果误服白磷而中毒时,要尽快用CuSO₄溶液洗胃,发生的反应为:2P+5CuSO₄+8H₂O=5Cu+2H₃PO₄+5H₂SO₄ 11P+15CuSO₄+24H₂O=5Cu₃P↓+6H₃PO₄+15H₂SO₄ 通过上述反应将剧毒的白磷转化为无毒的H₃PO₄或不溶于酸的Cu₃P沉淀。
与同分异构体关系
同分异构现象是指化合物具有相同的分子式,但具有不同结构的现象。
常见的异构类型有:
**1.**碳链异构由于分子中碳链形状不同而产生的异构现象。如正丁烷和异丁烷。
**2.**位置异构 由于取代基或官能团在碳链上或碳环上的位置不同而产生的异构现象。如: 1-丁炔与2-丁炔,1-丙醇与2-丙醇。
**3.**官能团异构分子中由于官能团不同而产生的异构现象。如:单烯烃与环烷烃,醇与醚,醛与酮,炔烃与二烯烃,酯和羧酸,酚和芳香醇。
**4.**立体异构结构相似,但由于微小偏差导致结构不同。
(1)顺反异构立体异构的一种,由于双键不能自由旋转引起的,一般指烯烃的双键或多取代环烃的取代基位于环的不同侧造成的同分异构。
(2)光学异构构造相同的分子,如使其一平面偏振光向右偏转,另一侧向左。则两种互为光学异构体。
(3)手性异构手性异构就是光学异构。手性异构的两分子像人的左右手一样镜像对称。
**5.**构象异构同一种化合物的构象,可通过单键旋转由一种变为另一种,则这两种互为构象异构体。
注意:
同分异构体是存在于化合物的概念,而同素异形体的适用对象是单质。
与同位素关系
同素异形体是指同种元素的不同单质, 它们是单质,换句话说它是物质。比如石墨和金刚石,它们是物质,而且是同一种元素,但是结构不同,所以它们是同素异形体。
而同位素是中子数不同但质子数相同的同种元素的不同原子,它只是原子,比如,没有中子的₁H和有一个中子的₂H 或者 ₂C1和₄C1,它们只是原子而已,它们不是单独的物质所以它们是同位素。
H₂和H₃:H₃是3个氢原子,H2是两个氢原子,它们是不同的物质,它们是同素异形体。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国