表述方式
物体内能的增加等于物体吸收的热量和对物体所作的功的总和1,表达式为△U=Q+W。
系统在绝热状态时,功只取决于系统初始状态和结束状态的能量,和过程无关。
孤立系统的能量永远守恒。
系统经过绝热循环,其所做的功为零,因此第一类永动机是不可能的(即不消耗能量做功的机械)。
发展简史
19世纪初,由于蒸汽机的进一步发展,迫切需要研究热和功的关系,对蒸汽机“出力”作出理论上的分析,所以热与机械功的相互转化得到了广泛的研究2。
 埃瓦特(Peter Ewart,1767—1842)对煤的燃烧所产生的热量和由此提供的“机械动力”之间的关系作了研究,建立了定量联系。
埃瓦特(Peter Ewart,1767—1842)对煤的燃烧所产生的热量和由此提供的“机械动力”之间的关系作了研究,建立了定量联系。
丹麦工程师和物理学家柯尔丁(L.Colding,1815—1888)对热、功之间的关系也作过研究。他从事过摩擦生热的实验,1843年丹麦皇家科学院对他的论文签署了如下的批语 “柯尔丁的这篇论文的主要思想是由于摩擦、阻力、压力等造成的机械作用的损失,引起了物体内部的如热、电以及类似的动作,它们皆与损失的力成正比。”
俄国的赫斯(G.H.Hess,1802—1850)在更早就从化学的研究得到了能量转化与守恒的思想。他原是瑞士人,3岁时到俄国,当过医生,在彼得堡执教,他以热化学研究著称。
1836年赫斯向彼得堡科学院报告:“经过连续的研究,我确信,不管用什么方式完成化合,由此发出的热总是恒定的,这个原理是如此之明显,以至于如果我不认为已经被证明,也可以不加思索就认为它是一条公理。”
于1840年3月27日在一次科学院演讲中提出了一个普遍的表述:“当组成任何一种化学化合物时,往往会同时放出热量,这热量不取决于化合是直接进行还是经过几道反应间接进行。”以后他把这条定律广泛应用于他的热化学研究中。
赫斯的这一发现第一次反映了热力学第一定律的基本原理;热和功的总量与过程途径无关,只决定于体系的始末状态。体现了系统的内能的基本性质——与过程无关。赫斯的定律不仅反映守恒的思想,也包括了“力”的转变思想。至此,能量转化与守恒定律已初步形成。
其实法国工程师萨迪·卡诺(Sadi Carnot,1796—1832)早在1830年就已确立了功热相当的思想,他在笔记中写道:“热不是别的什么东西,而是动力,或者可以说,它是改变了形式的运动,它是(物体中粒子的)一种运动(的形式)。当物体的粒子的动力消失时,必定同时有热产生,其量与粒子消失的动力精确地成正比。相反地,如果热损失了,必定有动力产生。”
“因此人们可以得出一个普遍命题:在自然界中存在的动力,在量上是不变的。准确地说,它既不会创生也不会消灭;实际上,它只改变了它的形式。”
卡诺未作推导而基本上正确地给出了热功当量的数值:370千克米/千卡。由于卡诺过早地死去,他的弟弟虽看过他的遗稿,却不理解这一原理的意义,直到1878年,才公开发表了这部遗稿。这时,热力学第一定律早已建立了。
对能量转化与守恒定律作出明确叙述的,首先要提到三位科学家。他们是德国的迈尔(RobertMayer,1814—1878)、赫姆霍兹(Hermann von Helmholtz,1821—1894)和英国的焦耳。
迈尔的实验
迈尔是一位医生。在一次驶往印度尼西亚的航行中 ,迈尔作为随船医生,在给生病的船员放血时,得到了重要启示,发现静脉血不像生活在温带国家中的人那样颜色暗淡,而是像动脉血那样新鲜。当地医生告诉他,这种现象在辽阔的热带地区是到处可见的。他还听到海员们说,暴风雨时海水比较热。这些现象引起了迈尔的沉思。他想到,食物中含有化学能,它像机械能一样可以转化为热。在热带高温情况下,机体只需要吸收食物中较少的热量,所以机体中食物的燃烧过程减弱了,因此静脉血中留下了较多的氧。他已认识到生物体内能量的输入和输出是平衡的。迈尔在1842年发表的题为《热的力学的几点说明》中,宣布了热和机械能的相当性和可转换性,他的推理如下 :
“力是原因:因此,我们可以全面运用这样一条原则来看待它们,即‘因等于果’。设因c有果e,则c=e;反之,设e为另一果f之因,则有e=f等等,c=e=f=…=c在一串因果之中,某一项或某一项的某一部分绝不会化为乌有,这从方程式的性质就可明显看出。这是所有原因的第一个特性,我们称之为不灭性。”
接着迈尔用反证法,证明守恒性(不灭性):
“如果给定的原因c产生了等于其自身的结果e,则此行为必将停止;c变为e;若在产生e后,c仍保留全部或一部分,则必有进一步的结果,相当于留下的原因c的全部结果将>e,于是就将与前提c=e矛盾。”“相应的,由于c变为e,e变为f等等,我们必须把这些不同的值看成是同一客体出现时所呈的不同形式。这种呈现不同形式的能力是所有原因的第二种基本特性。把这两种特性放在一起我们可以说,原因(在量上)是不灭的,而(在质上)是可转化的客体。”
迈尔的结论是:“因此力(即能量)是不灭的、可转化的、不可秤量的客体。”
迈尔这种推论方法显然过于笼统,难以令人信服,但他关于能量转化与守恒的叙述是最早的完整表达。
迈尔在1845年发表了第二篇论文: 《有机运动及其与新陈代谢的联系》,该文更系统地阐明能量的转化与守恒的思想。他明确指出:“无不能生有,有不能变无”,“在死的和活的自然界中,这个力(按:即能量)永远处于循环转化的过程之中。任何地方,没有一个过程不是力的形式变化!”他主张:“热是一种力,它可以转变为机械效应。”论文中还具体地论述了热和功的联系,推出了气体定压比热和定容比热之差C**p-C**v等于定压膨胀功R的关系式。称Cp-Cv=nR为迈尔公式。1
接着迈尔又根据狄拉洛希(Delaroche)和贝拉尔德(Berard)以及杜隆(Dulong)气体比热的实验数据C**p=0.267卡/克·度、 C**v=0.188卡/克·度计算出热功。
计算过程如下:
在定压下使1厘米3空气加热温升1度所需的热量为:Q**p=mc**pΔt=0.000347卡(取空气密度ρ=0.0013克/厘米3)。相应地,在定容下加热同量空气温升 1度消耗的热Q**v=0.000244卡。二者的热量差Q**p-Q**v=0.000103卡。另一方面,温度升高1度等压膨胀时体积增大为原体积的1/274倍;气体对外作的功,可以使1.033千克的水银柱升高1/274厘米。即功=1.033×1/27400 =3.78×10-5千克·米。于是迈尔得出热功当量为
J=A/(Q**p-Q**v)=3.78×10-5/1.03×10-7=367千克·米/千卡。
或3597焦耳/千卡,21世纪初的精确值为4187焦耳/千卡。
迈尔还具体地考察了另外几种不同形式的力。他以起电机为例说明了“机械效应向电的转化。”他认为:“下落的力”(即重力势能)可以用“重量和(下落)高度的乘积来量度。”“与下落的力转变为运动或者运动转变为下落的力无关,这个力或机械效应始终是不变的常量。”
迈尔第一个在科学史中将热力学观点用于研究有机世界中的现象,他考察了有机物的生命活动过程中的物理化学转变,确信“生命力”理论是荒诞无稽的。他证明生命过程无所谓“生命力”,而是一种化学过程,是由于吸收了氧和食物,转化为热。这样迈尔就将植物和动物的生命活动,从唯物主义的立场,看成是能的各种形式的转变。
1848年迈尔发表了《天体力学》一书,书中解释陨石的发光是由于在大气中损失了动能。他还应用能量守恒原理解释了潮汐的涨落。迈尔虽然第一个完整地提出了能量转化与守恒原理,但是在他的著作发表的几年内,不仅没有得到人们的重视,反而受到了一些著名物理学家的反对。由于他的思想不合当时流行的观念,还受到人们的诽谤和讥笑,使他在精神上受到很大刺激,曾一度关进精神病院,倍受折磨。
赫姆霍兹的研究3
从多方面论证能量转化与守恒定律的是德国的海曼·赫姆霍兹。他曾在著名的生理学家缪勒(Johannes Müller)的实验室里工作过多年,研究过“动物热。”他深信所有的生命现象都必得服从物理与化学规律。他早年在数学上有过良好的训练,同时又很熟悉力学的成就,读过牛顿、达朗贝尔、拉格朗日等人的著作,对拉格朗日的分析力学有深刻印象。他的父亲是一位哲学教授,和著名哲学家费赫特(Fichte)是好朋友。海曼·赫姆霍兹接受了前辈的影响,成了康德哲学的信徒,把自然界大统一当作自己的信条。他认为如果自然界的“力”(即能量)是守恒的,则所有的 “力” 都应和机械 “力” 具有相同的量纲, 并可还原为机械 “力”。1847年,26岁的赫姆霍兹写成了著名论文《力的守恒》,充分论述了这一命题 。这篇论文是1847年7月23日在柏林物理学会会议上的报告,由于被认为是思辨性、缺乏实验研究成果的一般论文,没有在当时有国际声望的《物理学年鉴》上发表,而是以小册子的形式单独印行的。
但是历史证明,这篇论文在热力学的发展中占有重要地位,因为赫姆霍兹总结了许多人的工作,一举把能量概念从机械运动推广到了所有变化过程,并证明了普遍的能量守恒原理。这是一个十分有力的理论武器,从而可以更深入地理解自然界的统一性。
赫姆霍兹在这篇论文一开头就声称,他的“论文的主要内容是面对物理学家,”他的目的是“建立基本原理,并由基本原理出发引出各种推论,再与物理学不同分支的各种经验进行比较。”
在他的论述中有一明显的趋向,就是企图把一切自然过程都归结于中心力的作用。大家都知道,在只有中心力的作用下,能量守恒是正确的,但是这只是能量守恒原理的一个特例,把中心力看成是普遍能量守恒的条件就不正确了。
他的论文共分六节,前两节主要是回顾力学的发展,强调了活力守恒(即动能守恒),进而分析了“力”的守恒原理(即机械能守恒原理);第三节涉及守恒原理的各种应用;第四节题为“热的力当量性,”他明确地摒弃了热质说,把热看成粒子(分子或原子)运动能量的一种形式。第五节“电过程的力相当性”和第六节“磁和电磁现象的力相当性”讨论各种电磁现象和电化学过程,特别是电池中的热现象对能量转化关系进行了详细研究。文章最后提到能量概念也有可能应用于有机体的生命过程,他的论点和迈尔接近。不过,看来他当时并不知道迈尔的工作。
赫姆霍兹在结束语中写道:“通过上面的叙述已经证明了我们所讨论的定律没有和任何一个迄今所知的自然科学事实相矛盾,反而却引人注目地为大多数事实所证实。……这定律的完全验证,也许必须看成是物理学最近将来的主要课题之一。”
实际上,实验验证这一定律的工作早在赫姆霍兹论文之前就已经开始了。焦耳在这方面做出了巨大贡献。
焦耳的实验研究
焦耳是英国著名实验物理学家。1818年他出生于英国曼彻斯特市近郊,是富有的酿酒厂主的儿子。他从小在家由家庭教师教授, 16岁起与其兄弟一起到著名化学家道尔顿(John Dalton,1766—1844)那里学习,这在焦耳的一生中起了关键的指导作用,使他对科学发生了浓厚的兴趣,后来他就在家里做起了各种实验,成为一名业余科学家。
这时正值电磁力和电磁感应现象发现不久,电机——当时叫磁电机(electric-magnetic engine)——刚刚出现, 人们还不大了解电磁现象的内在规律,也缺乏对电路的深刻认识,只是感到磁电机非常新奇,有可能代替蒸汽机成为效率更高、管理方便的新动力,于是一股电气热潮席卷了欧洲,甚至波及美国。焦耳当时刚20岁,正处于敏感的年龄,家中又有很好的实验条件(估计他父亲厂里有蒸汽机),对革新动力设备很感兴趣,就投入到电气热潮之中,开始研究起磁电机来。
从1838年到1842年的几年中,焦耳一共写了八篇有关电机的通讯和论文,以及一篇关于电池、三篇关于电磁铁的论文。他通过磁电机的各种试验注意到电机和电路中的发热现象,他认为这和机件运转中的摩擦现象一样,都是动力损失的根源。于是他就开始进行电流的热效应的研究。
1841年他在《哲学杂志》上发表文章《电的金属导体产生的热和电解时电池组中的热》,叙述了他的实验:为了确定金属导线的热功率,让导线穿过一根玻璃管,再将它密缠在管上,每圈之间留有空隙,线圈终端分开。然后将玻璃管放入盛水的容器中,通电后用温度计测量水产生的温度变化。实验时,他先用不同尺寸的导线,继而又改变电流的强度,结果判定“在一定时间内伏打电流通过金属导体产生的热与电流强度的平方及导体电阻的乘积成正比。”这就是著名的焦耳定律,又称iR定律。
随后,他又以电解质做了大量实验,证明上述结论依然正确。
iR定律的发现使焦耳对电路中电流的作用有了明确的认识。 他仿照动物体中血液的循环,把电池比作心肺,把电流比作血液,指出:“电可以看成是携带、安排和转变化学热的一种重要媒介”,并且认为,在电池中“燃烧”一定量的化学“燃料”,在电路中(包括电池本身)就会发出相应大小的热,和这些燃料在氧气中点火直接燃烧所得应是一样多。请注意,这时焦耳已经用上了“转变化学热”一词,说明他已建立了能量转化的普遍概念,他对热、化学作用和电的等价性已有了明确的认识。
然而,这种等价性的最有力证据,莫过于热功当量的直接实验数据。正是由于探索磁电机中热的损耗,促使焦耳进行了大量的热功当量实验。1843年焦耳在《磁电的热效应和热的机械值》一文中叙述了他的目的,写道:
“我相信理所当然的是:磁电机的电力与其它来源产生的电流一样,在整个电路中具有同样的热性质。当然,如果我们认为热不是物质,而是一种振动状态,就似乎没有理由认为它不能由一种简单的机械性质的作用所引起,例如像线圈在永久磁铁的两极间旋转的那种作用。与此同时,也必须承认,迄今尚未有实验能对这个非常有趣的问题作出判决,因为所有这些实验都只限于电路的局部,这就留下了疑问,究竟热是生成的,还是从感应出磁电流的线圈里转移出来的?如果热是线圈里转移出来的,线圈本身就要变冷。……所以,我决定致力于清除磁电热的不确定性。”
焦耳把磁电机放在作为量热器的水桶里,旋转磁电机,并将线圈的电流引到电流计中进行测量,同时测量水桶的水温变化。实验表明,磁电机线圈产生的热也与电流的平方成正比。
焦耳又把磁电机作为负载接入电路,电路中另接一电池,以观察磁电机内部热的生成,这时,磁电机仍放在作为量热器的水桶里,焦耳继续写道:“我将轮子转向一方,就可使磁电机与电流反向而接,转向另一方,可以借磁电机增大电流。前一情况,仪器具有磁电机的所有特性,后一情况适得其反,它消耗了机械力。”
比较磁电机正反接入电路的实验,焦耳得出结论:“我们从磁电得到了一种媒介,用它可以凭借简单的机械方法,破坏热或产生热。”
至此,焦耳已经从磁电机这个具体问题的研究中领悟到了一个具有普遍意义的规律,这就是热和机械功可以互相转化,在转化过程中一定有当量关系。他写道 :
“在证明了热可以用磁电机生成,用磁的感应力可以随意增减由于化学变化产生的热之后,探求热和得到的或失去的机械功之间是否存在一个恒定的比值,就成了十分有趣的课题。为此目的,只需要重复以前的一些实验并同时确定转动仪器所需的机械力。”
焦耳在磁电机线圈的转轴上绕两条细线,相距约27.4米处置两个定滑轮,跨过滑轮挂有砝码,砝码约几磅重(1磅=0.45359千克),可随意调整。线圈浸在量热器的水中,从温度计的读数变化可算出热量,从砝码的重量及下落的距离可算出机械功。在 1843年的论文中,焦耳根据13组实验数据取平均值得如下结果:
“能使1磅的水温度升温华氏一度的热量等于(可转化为)把838磅重物提升1英尺的机械功。”
838磅·英尺相当于1135焦耳,这里得到的热功当量838磅·英尺/英热单位等于4.511焦耳/卡(现代公认值为4.187焦耳/卡)。
焦耳并没有忘记测定热功当量的实际意义,就在这篇论文中他指出,最重要的实际意义有两点:(1)可用于研究蒸汽机的出力;(2)可用于研究磁电机作为经济的动力的可行性。可见,焦耳研究这个问题始终没有离开他原先的目标。
焦耳还用多孔塞置于水的通道中,测量水通过多孔塞后的温升,得到热功当量为770磅·英尺/英热单位(4.145焦耳/卡)。这是焦耳得到的与现代热功当量值最接近的数值。

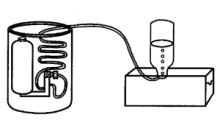
1845年,焦耳报道他在量热器中安装一带桨叶的转轮,如图,经滑轮吊两重物下滑,桨轮旋转,不断搅动水使水升温,测得热功当量为890磅·英尺/英热单位,相当于4.782焦耳/卡。
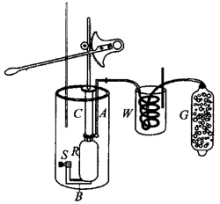
同年,焦耳写了论文《空气的稀释和浓缩所引起的温度变化》,记述了如下实验:把一个带有容器R的压气机C放在作为量热器的水桶A中,如图2-2。压气机把经过干燥器G和蛇形管W的空气压缩到容器R中,然后测量空气在压缩后的温升,从温升可算出热量。气压从一个大气压变为22个大气压,压缩过程视为绝热过程,可计算压气机作的功。由此得到热功当量为823及795磅·英尺/英热单位。然后,经蛇形管释放压缩空气,量热器温度下降,又可算出热功当量为820、 814、760磅· 英尺/英热单位, 从空气的压缩和膨胀得到的平均值为798磅·英尺/英热单位,相当于4.312焦耳/卡。3
1849年6月,焦耳作了一个《热功当量》的总结报告,全面整理了他几年来用桨叶搅拌法和铸铁摩擦法测热功当量的实验,给出如下结果(单位均以磅·英尺/英热单位表示):
|| ||
焦耳的实验结果处理得相当严密,在计算中甚至考虑到将重量还原为真空中的值。对上述结果,焦耳作了分析,认为铸铁摩擦时会有微粒磨损,要消耗一定的功以克服其内聚力,因此所得结果可能偏大。汞和铸铁在实验中不可避免会有振动,产生微弱的声音,也会使结果偏大。
在这三种材料中,以水的比热最大,所以比较起来,应该是用水作实验最准确。 因此, 在他的论文结束时,取772作为最后结果, 这相当于4.154焦耳/卡。对此,他概括出两点:
“第一,由物体,不论是固体或液体,摩擦产生的热量总是正比于消耗的力之量;第二,使一磅水(在真空中称量,用于55°-60°)的温度升高1℉,所需消耗的机械力相当于772磅下落1英尺。”
焦耳从1843年以磁电机为对象开始测量热功当量,直到1878年最后一次发表实验结果,先后做实验不下四百余次,采用了原理不同的各种方法,他以日益精确的数据,为热和功的相当性提供了可靠的证据,使能量转化与守恒定律确立在牢固的实验基础之上。2
定律形式
表述形式:热能可以从一个物体传递给另一个物体,也可以与机械能或其他能量相互转换,在传递和转换过程中,能量的总值不变。
在工程热力学范围内,热力学第一定律可表述为:热能和机械能在转移或转换时,能量的总量必定守恒。
基本内容:热可以转变为功,功也可以转变为热;消耗一定的功必产生一定的热,一定的热消失时,也必产生一定的功。
热力学第一定律的另一种表述是:第一类永动机是不可能造成的。这是许多人幻想制造的能不断地作功而无需任何燃料和动力的机器,是能够无中生有、源源不断提供能量的机器。显然,第一类永动机违背能量守恒定律。
数学式的表达为:
在热力学中,系统发生变化时,设与环境之间交换的热为Q(吸热为正,放热为负),与环境交换的功为W(环境对系统做功为正,系统对环境做功为负),4可得热力学能(亦称内能)的变化为△U=Q+W。
普遍的能量转化和守恒定律是一切涉及热现象的宏观过程中的具体表现。热力学的基本定律之一。
热力学第一定律是对能量守恒和转换定律的一种表述方式。
阐释说明
表征热力学系统能量的是内能(即热力学能)。4在热力学中,把除了传热之外的能量变化都叫功,系统与环境交换能量,使内能有所变化。根据能量守恒定律,系统由初态Ⅰ经过任意过程到达终态Ⅱ后,内能的变化△U应等于在此过程中外界对系统传递的热量Q 和环境对系统作功W之差(谁对谁做功取决于W值的正负),即 这就是热力学第一定律的表达式。对于还有因物质从外界进入系统而带入的能量Z,则不在热力学第一定律的考察范围之内,这是热力学第一定律的先决条件。也就是要求系统是一个封闭系统。例如假设有如下实验:实验从一个装有氧气分子的箱子(系统)开始,箱子密闭,但顶上有一个可以开启的盖子,箱子外部(环境)为真空,某一时刻(始态)打开箱子盖,由于外面是真空,氧气分子将自发的扩散出去。一些氧气分子离开了箱子,自然就带走了系统的一部分内能,而这一部分内能的损失,既不反映为做功,也不反映为传热。因此热力学第一定律无法处理,因物质的增加或减少而引起的内量变化。
这就是热力学第一定律的表达式。对于还有因物质从外界进入系统而带入的能量Z,则不在热力学第一定律的考察范围之内,这是热力学第一定律的先决条件。也就是要求系统是一个封闭系统。例如假设有如下实验:实验从一个装有氧气分子的箱子(系统)开始,箱子密闭,但顶上有一个可以开启的盖子,箱子外部(环境)为真空,某一时刻(始态)打开箱子盖,由于外面是真空,氧气分子将自发的扩散出去。一些氧气分子离开了箱子,自然就带走了系统的一部分内能,而这一部分内能的损失,既不反映为做功,也不反映为传热。因此热力学第一定律无法处理,因物质的增加或减少而引起的内量变化。
对于无限小过程,热力学第一定律的微分表达式为 。因U是状态函数,
。因U是状态函数, 是全微分;Q、W是过程量,
是全微分;Q、W是过程量, 和
和 只表示微小量并非全微分,用符号
只表示微小量并非全微分,用符号 以示区别。且U只与系统的始末态有关。4
以示区别。且U只与系统的始末态有关。4
热力学第一定律的另一种表述是:第一类永动机是不可能造成的。这是许多人幻想制造的能不断地做功而无需任何燃料和动力的机器,是能够无中生有、源源不断提供能量的机器。显然,第一类永动机违背能量守恒定律。
适用范围
**系统必须为封闭系统,有物质交换的敞开系统不在热力学第一定律的考虑范围之内。即基本定义式无法使用。**5
热力学第一定律本质上与能量守恒定律是的等同的,是一个普适6的定律,适用于宏观世界和微观世界的所有体系,适用于一切形式的能量。
自1850年起,科学界公认能量守恒定律是自然界普遍规律之一。能量守恒与转化定律可表述为:
自然界的一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,但在转化过程中,能量的总值不变。
热力学第一定律是能量守恒与转化定律在热现象领域内所具有的特殊形式,是人类经验的总结,也是热力学最基本的定律之一。它适用于宏观世界和微观世界的所有体系,适用于一切形式的能量。7
应用领域
热容量与焓
热力学第一定律在p-V系统中的应用。
对于气体、液体和各向同性的固体,在不考虑表面张力和没有外力场的情况下,它们的状态可以用p、V、T三个量中的任意两个作为状态参量来描述,这样的物体系统为p-V系统3。
对于p-V系统,在无限小的准静态过程中,外界对系统所做的微量功dW=-pdV。
热力学第一定律对理想气体的应用
热力工程上实施热力过程的目的有两点:一是实现预期的能量转换;二是达到预期的状态变化。
在热力设备中常以气体为工作物质(简称“工质”),分析气体在几种典型的热力学过程中状态的变化及能量的转换规律,是有实际意义的。为简单计,人们只以理想气体为工质,并一般的只限于讨论可逆过程6。
定律影响
热力学第一定律是热力学的基础,而且在能源方面有广泛的应用,能源是人类社会活动的物质基础,社会得以发展离不开优质能源的出现和先进能源技术的使用,能量资源的范围随着科学技术的发展而扩大,所以热力学第一定律的广阔发展前景也将越来越光明。5




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国