3月14日,记者从空军军医大学西京医院获悉,该院的异种肝脏移植临床研究取得重大突破,成功将一只多基因编辑猪的全肝以辅助的方式移植到一位脑死亡患者体内。术中,移植肝脏恢复血流后即刻分泌胆汁,未见超急性排斥反应,已持续工作超96小时。经科技查新,国内外未见同类报道,属世界首例。
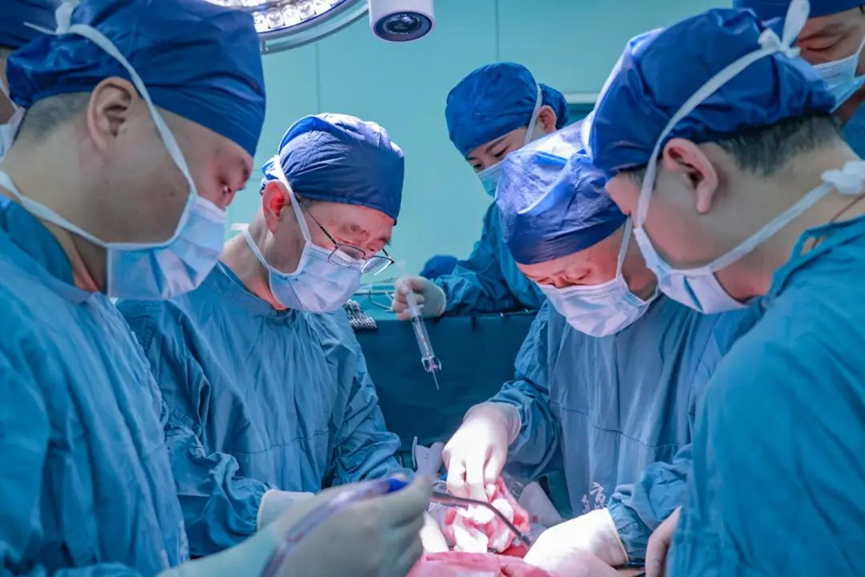
西京医院窦科峰院士、陶开山主任等主刀手术
该研究首次探索了“基因编辑猪-人”肝脏异种移植的可行性,在科学理论创新、核心技术攻关、军事医学应用等方面取得原创性突破,将在救治修复、功能重建、移植替代,特别是重要脏器移植中发挥不可替代作用。
我国有近4亿肝病患者,700多万肝硬化患者,同时,每年新增30万—50万的肝衰竭患者。对于肝衰竭,肝移植是唯一有效的根治方式。现实中,很多人因等不到人类供肝而失去生命,而异种肝移植不受供肝数量限制,可使更多终末期肝病患者获益,未来可能完全替代同种肝移植。
2021年至2023年,异种移植的基础与临床研究均取得巨大进步——美国相继开展了4例基因编辑猪-脑死亡受体肾脏移植、1例基因编辑猪-脑死亡受体心脏移植、2例基因编辑猪-人心脏移植手术,这一系列医学突破引发了广泛关注,使得以基因编辑猪为供体的异种移植成为缓解移植器官短缺的新希望。
目前,国际上关于异种肝脏移植的研究,尚处于使用狒狒、猕猴等动物作为移植受体阶段。据中国科学院院士窦科峰介绍,相对于肾脏和心脏,肝脏涉及合成、分解、凝血、解毒和免疫等功能,解剖结构和生理功能更为复杂,因此,基因编辑猪的肝脏还不能完全替代人类肝脏发挥功能,异种肝脏移植技术难度和科学意义更大。如何推动异种肝移植走向临床,是当下领域内学者十分关注的难点科学问题。
从2013年亚洲首例转基因猪-藏酋猴异种异位部分肝移植获得成功,到2020年多基因编辑猪-猴肝心肾移植创造肝移植受体存活世界纪录,到2022年成功实施国际首例多基因编辑猪-猴多器官多组织同期联合移植,再到2023年多基因编辑猪-猴异位辅助肝移植取得新突破,西京医院在长达11年的“猪猴异种肝移植动物实验”基础上,开展了此次基因编辑猪-脑死亡受者肝移植,以多基因编辑猪作为供体,脑死亡患者作为受体,实施了保留移植患者自身肝脏的辅助性肝移植,模拟了临床肝衰患者的替代支持治疗过程。实施方案先后通过学术委员会、伦理委员会、器官移植委员会和动物委员会论证,严格按照国家有关规定逐项进行。
手术供体猪由成都中科奥格生物科技有限公司提供,O型血,23公斤,敲除了3种会引起“超急性排斥和急性体液性排斥”的猪抗原,转入了2种“人补体调节蛋白”、1种“人凝血调节蛋白”。移植受者为一例重型闭合性颅脑损伤患者,经过医院全力抢救,三次评估均认证为脑死亡,家属同意无偿参与异种肝移植科学研究,为人类医学进步做出贡献。
3月10日,麻醉科、外科手术室、重症医学科等14个科室共同为手术保驾护航。供体猪全麻,供肝称重700克,组织学检查显示肝组织形态结构正常。受者常规麻醉,供肝肝动脉与受者腹主动脉吻合。移植肝脏开放血流后,色泽红润、质地良好,可见金黄色胆汁流出,说明猪肝在人体内发挥了生理功能。术中B超显示移植肝灌注良好,整个手术历时约9小时顺利结束。
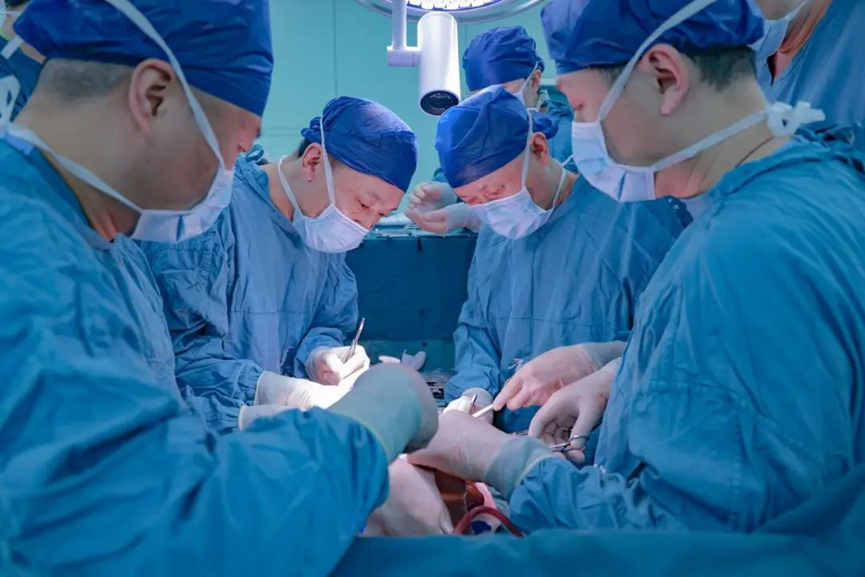
西京医院陶开山主任、段维勋副教授、杨诏旭副教授吻合肝脏相关血管
术后24小时,受体血流动力学平稳、移植肝脏胆汁分泌良好、B超显示移植肝脏血供良好、移植肝脏穿刺病理显示未见排斥反应。据西京医院肝胆外科陶开山主任介绍,移植的基因编辑猪肝脏无论从胆汁、血供和病理结果来讲,情况良好,手术效果超出团队预想。
“这是医学界第一次将基因编辑猪肝植入人体内,在目前观察的96小时内,移植的基因编辑猪肝脏,在人体内能够发挥生理功能,正常分泌胆汁,说明有可能替代人类肝脏。”窦科峰表示,该项研究的顺利开展,是异种器官移植领域的重大突破,也是异种肝移植向临床迈进的关键一步,为下一步的临床应用提供了理论依据和数据支撑。







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国