据国家癌症中心最新数据显示,随着年龄的增长,我国肿瘤发病率呈上升趋势,并于 60 岁年龄组之后均大幅度上升,在 80-84 岁年龄组达到峰值,尽管近年来癌症逐渐呈现年轻化趋势,但从统计数据来看,60 岁以上的老年人仍是癌症的高发群体。ABT263是第一批通过有效激活凋亡途径来清除SNC的衰老药物之一,它可以选择性地清除衰老细胞。
2024 年 3 月 18 日, 来自法国和加拿大的科学家们在 Nature communications 上发表了研究论文 Senescence drives immunotherapy resistance by inducing an immunosuppressive tumor microenvironment 。该研究利用单细胞转录组学分析,发现注射 ABT263 (Navitoclax) 能够逆转肿瘤微环境 (TME) 中骨髓细胞免疫抑制现象。
在体外实验中,研究发现消除上述骨髓细胞能够恢复 CD8+ T 细胞的增殖,并缓解体内的免疫治疗耐药性。
研究内容
研究人员构建了两种诱导衰老小鼠模型,以模拟恶性肿瘤患者在接受免疫治疗之前暴露于细胞毒性药物的情况。发现消除 p16+ 细胞能够恢复 αPD-L1 的功效,同时提高小鼠的存活率,即人工去除小鼠体内衰老细胞有助于恢复免疫治疗效果。
接着,在明确电离辐射诱导(TBI)的衰老极大地损害了小鼠的免疫细胞功能这一科学问题后,该研究通过流式细胞术监测了肿瘤中的免疫细胞浸润情况。发现衰老通过影响TME进而限制肿瘤内 CD8+ T细胞的扩张,最终破坏 αPD-L1 免疫治疗效果。
最后,研究人员通过单细胞转录组学对小鼠的TME组成进分析。同时使用阻断抗体去除 TBI 小鼠中的Ly6c+单核细胞,发现联合使用 Ly6c 和 αPD-L1 阻断抗体能够显著地抑制肿瘤生长。上述结果表明,骨髓细胞在衰老环境下加剧免疫抑制特征,同时诱导机体对免疫治疗的抵抗。
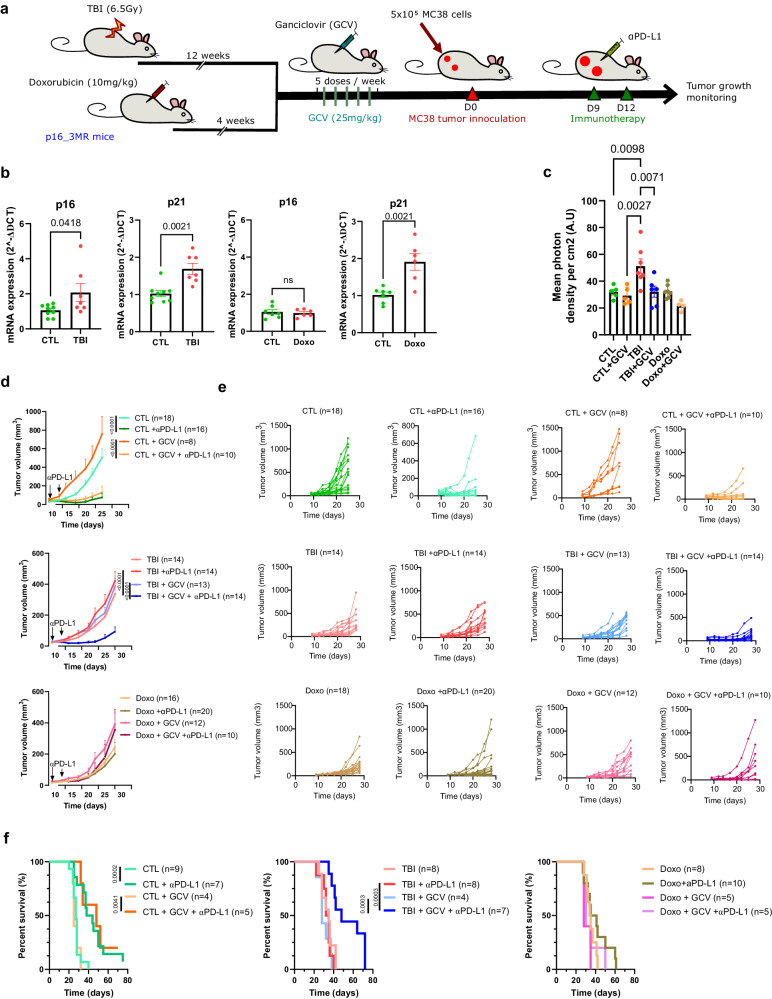
图片来源:Nature communications
综上所述,在免疫细胞健康受损的情况下,ICI 的应用潜力可能会受到限制。该研究发现癌症免疫疗法的功效因小鼠体内衰老细胞的积累、治疗诱导衰老的背景而降低,机体对免疫治疗的抵抗与肿瘤内 CD8+ T细胞积累及活化的减少有关。因此,在使用 ICI 之前接受抗衰老药物治疗可能提高癌症免疫疗法的有效性。
展望
免疫检查点抑制剂(ICIs)优化了肿瘤患者的治疗策略,极大地推动了恶性肿瘤的药物治疗发展进程。截至目前,18 款 ICIs 在中国上市,包括 10 个 PD-1 抑制剂,6 个 PD-L1 抑制剂,1 个 CTLA-4 抑制剂,1 个 PD-L1/CTLA-4 双特异性抗体。这些 ICIs 在抗肿瘤临床治疗中中取得了显著的疗效,拯救了无数人的性命。然而,约 50%-75% 接受 ICIs 治疗的癌症患者对免疫治疗产生耐药性或在几年后复发,严重地缩短了生存期。
因此,进一步解析 ICIs 的治疗机制对于攻克免疫治疗耐药性具有重要意义。诚如上文所提,部分人群对 ICIs 治疗产生耐药性或复发,如何提高 ICIs 的有效性和安全性是亟待解决的科学问题,也是目前肿瘤免疫治疗领域的热点问题。
2022 年 5 月,中国临床肿瘤学会免疫治疗专家委员会发布了《免疫检查点抑制剂特殊人群应用专家共识》。该共识基于中国特殊人群特征和既往已发表的数据,聚焦七大类特殊人群,提出了十条专家共识。其中七大类特殊人群包括自身免疫性疾病(AIDs)患者、HBV/HCV/HIV 携带者及结核(TB)患者、老年患者、接受实体器官移植(SOT)或造血干细胞移植(HSCT)患者、胸腺肿瘤(TETs)患者、伴随用药患者、主要脏器功能不全及体能状况评分≥2 分患者。
共识指出这些患者常常被排除在 ICIs 临床试验之外,其应用 ICIs 的有效性和安全性数据仍非常缺乏,导致实际临床治疗中困难重重,合理化地使用 ICIs 治疗对延长患者生存期具有重要作用。因此,针对患者自身健康状况指定个性化和全程化的 ICIs 治疗极为重要,期待本研究尽快应用于临床造福人类!







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国