基因编辑是指对目标基因进行删除、替换、插入等操作,以获得新的功能或表型,甚至创造新的物种[1]。在过去的三十年里,新的基因编辑技术不断发展,如ODM、TALENs、ZFNs和CRISPR-Cas系统[2],已在医学、生物学和农业等领域广泛应用。然而,基因编辑潜在的风险和道德伦理问题引发全球争议。
以CRISPR-Cas系统为例,目前,CRISPR-Cas系统由于操作过程简便、编辑效率高、支持多靶点编辑、编辑形式多样等优势[3],已成为世界各地研究实验室的主导基因组编辑技术[4]。在植物方面,CRISPR-Cas技术主要应用于改善营养、提高抗逆性、增强抗病性、提高免疫力、促进养分吸收、提高产量及植物结构等。在动物方面,主要涉及模式生物的基因功能、抗病性、细胞疗法、增产、改良药用或工业用动物、药品生产等。在人类健康方面,主要应用于遗传和临床疾病,如血友病、囊性纤维化、地中海贫血、癌症、白血病、黑色素瘤、艾滋病、镰状细胞贫血等[2]。
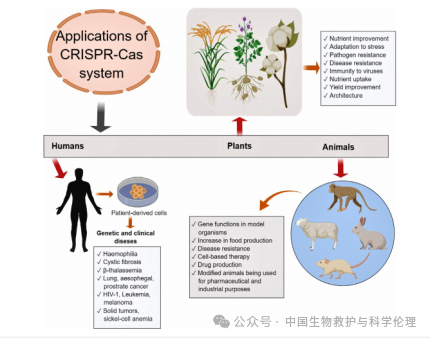
图 CRSPR-Cas系统在动植物临床和遗传疾病及性状改善中的应用
(源自:Debin Zhang, Amjad Hussain, Hakim Manghwar, et al..(2020)Genome editing with the CRISPR-Cas system: an art, ethics and global regulatory perspective.)
尽管现有的生物技术可以从结构上修饰包括人类在内的生物体的遗传背景[5],CRISPR-Cas系统可以有效地操纵基因组DNA[6],但技术和道德风险依然存在;特别是脱靶编辑和科学界的非法或不负责任的实验[2],会对生命体带来巨大的影响。“脱靶”风险,即工具酶在识别并切割靶位点的同时,也对与靶位点相似的DNA序列同样进行切割[7],在治疗中可能引起正常功能基因的功能缺失突变,或由于靶DNA序列以外的位点结合和断裂而使致病基因错误配对[8],甚至会导致染色体重排和其他类型的突变[9] [10],进而影响被编辑的生物体甚至其潜在的后代[11]。非法或不负责任的基因编辑实验则为实现某种目的,改变生物基因,进一步增加了生物安全风险,2019年公开的“基因编辑婴儿”事件就是典型例子。
另外,过多地使用CRISPR技术编辑野生种群的基因组可能会对生态系统产生破坏性和不可逆转的影响[12]。有一项调查显示,部分科学家的担忧包括:转基因微生物的逃逸;协助生物进化,可能会破坏自然遗传变异;基因逃逸可能对种群产生消极影响,破坏生态系统的平衡;基因驱动的动物释放可能会对生态系统和生物多样性产生负面影响等[13]。
面对潜在的风险,科学家们似乎也无法从技术的角度给出明确的判断,提出可行的措施。而普通大众对于基因编辑更多的是从伦理道德的角度表明自己的态度。一项美国的民意调查显示,受访者普遍认为风险大于收益,绝大多数人认为野生动物中的基因编辑至少对人类(84%)和自然(87%)有一定的风险[14]。
从达尔文的进化论到当代基因科学,从自然选择到人工选择,人类均扮演着重要的角色。无论是受益者还是受害者,全人类都将共同享有和承受。只是,少数人在选择物种的生死存亡和进化方向时,又让全人类一起承担不可预料的后果,似乎也欠缺点公平和民主。
文 | 蓝天
审核 | Ann
排版 | Candy
参考文献:
[1]卢俊南,褚鑫,潘燕平,等.基因编辑技术: 进展与挑战. 中国科学院院刊,2018,33(11):1184-1192.
[2]Debin Zhang, Amjad Hussain, Hakim Manghwar, et al..Genome editing with the CRISPR-Cas system: an art, ethics and global regulatory perspective.Plant Biotechnology Journal,2020,18(8):1651-1669.
[3]刘耀光,李构思,张雅玲,等. CRISPR/Cas植物基因组编辑技术研究进展[J].华南农业大学学报, 2019, 40(5): 38-49.
[4]Ledford, H. CRISPR, the disruptor. Nature, 2015,522(7544): 20-25.
[5]de Lecuona I., Casado M., Marfany G., et al.. Focus: genome editing: gene editing in humans: towards a global and inclusive debate for responsible research.The Yale Journal of Biology and Medicine, 2017,90(4): 673-681.
[6]Lyon J. Bioethics panels open door slightly to germline gene editing. JAMA, 2017,318,1639-1640.
[7]何秀斌,谷峰.基因组编辑脱靶研究进展.生物工程学报,2017,33(10):1757-1775.
[8]Cox D. B. T., Platt R. J. and Zhang F.. Therapeutic genome editing:prospects and challenges. Nature Medicine,2015,21, 121-131.
[9]Cong L., Ran F.A., Cox D., et al. Multiplex genome engineering using CRISPR/Cas systems. Science,2013,339: 819–823.
[10]Ghosh D., Venkataramani, P., Nandi, S. and Bhattacharjee, S. CRISPR–Cas9 a boon or bane: the bumpy road ahead to cancer therapeutics. Cancer Cell International,2019,19:12.
[11]Wang, X., Wang, Y., Wu, X., et al.Unbiased detection of off-target cleavage by CRISPR-Cas9 and TALENs using integrase-defective lentiviral vectors. Nature biotechnology, 2015,33(2), 175-178.
[12]Lunshof, J.. Regulate gene editing in wild animals. Nature,2015,521(7551):127-127.
[13]Corstiaan van Pelt..The Rise of Gene-Editing Technologies: Threats and Opportunities for Ecological Sustainability.Utrecht University,2018.
[14]Kohl P. A., Brossard D., Scheufele D. A., & Xenos, M. A.. Public views about editing genes in wildlife for conservation. Conservation Biology,2019,33(6):1286-1295.





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国