导读
近日,2021年化学诺奖得主、普林斯顿大学的David W. C. MacMillan教授课题组在Nature上报道了一种“铁催化+光氧化还原催化”平台,该平台利用铁卡宾反应性,使用现成的化学原料作为自由基源,并从六类以前未充分利用的离去基团中进行α-消除,提供了一种全新的卡宾形成方法。利用该方法,可从丰富且稳定的羧酸、氨基酸和醇中进行环丙烷化和σ-键插入到N-H、S-H和P-H键中,从而为卡宾介导的化学多样化挑战提供了通用解决方案。
正文
尽管卡宾和类卡宾在广泛的键形成过程中具有转化潜力,但广泛获取它们仍然难以实现。获取卡宾中间体的传统方法依赖于高能、双功能或伪双功能前体,如重氮(或前重氮)化合物、多卤化前体或锍叶立德。最终,这些起始原料的反应性和结构特异性限制了实用性,并且在一些情况下引发安全问题。为了解决卡宾化学中长期存在的局限性,MacMillan教授课题组设想将卡宾生成过程分为两个连续的单电子操作,在此,他们报道了一种通用的可见光介导策略,通过对六种不同类型的非传统离去基团进行自由基加成和还原诱导的α-消除序列,从丰富的前体中获取铁卡宾。
该方法可在温和条件下进行环丙烷化和X-H 插入反应,具有广泛的官能团耐受性。该方法引入了自由基金属光氧化还原化学的卡宾等价物,并避免了传统卡宾形成策略的许多缺点。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
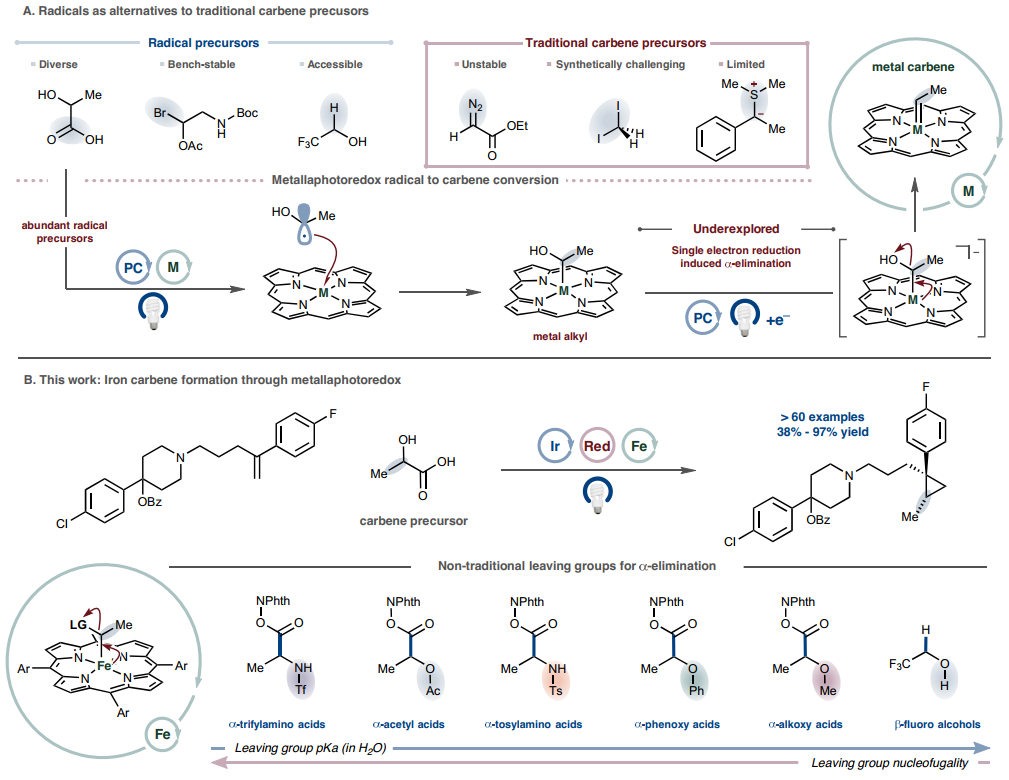
图1. 通过自由基中间体实现卡宾反应性
图片来源:Nature
作者设想是否有可能通过使用在初始自由基中心带有离去基团的单电子中间体来模拟叶立德型反应性。为了生成卡宾等价物,自由基金属化将产生第一个金属-碳键,从而无需亲核反应性。由于自由基金属化的能垒较低,该事件将以扩散速率或接近扩散速率发生,从而限制了非循环自由基偶联或加成型过程。金属中心的单电子还原将触发α-消除,踢走离去基团并提供所需的金属卡宾物种。自由基生成的时机和金属氧化还原状态的操控对于成功至关重要,因此,光催化被用作协调这些事件的一种手段(图 1a)。实现这一设想的反应将获得丰富的自由基生成模式,从而大大扩展金属卡宾的有限范围,进而扩展这些有机金属配合物所实现的转化类型。因此,要从自由基前体中获得所需的卡宾反应性,就必须研究设想的氧化还原诱导α-消除。
为了实现这种新的卡宾范式,需要解决三个问题:(1)从适当的前体生成自由基,(2)确定适合自由基结合的金属和控制氧化态变化的氧化还原窗口,(3)确定该金属在氧化态变化时与合成方便的离去基团进行α-消除的能力。为了评估提出的序列的可行性,选择了α-乙酰氧基羧酸,因为羧酸易于形成自由基。选择铁卟啉作为金属骨架来评估自由基结合和α-消除。选择环丙烷化作为模型反应来捕获假定的卡宾中间体的证据。在评估本文的反应序列时,观察到 2-(丙-1-烯-2-基)萘成功地通过乙酸酯保护的乳酸(活化为 N-羟基邻苯二甲酰亚胺[NHPI]酯)进行了环丙烷化,使用1,4-二氢-2,6-二甲基-3,5-吡啶二羧酸二乙酯(Hantzsch 酯)作为牺牲还原剂,在蓝光照射下,用(Fe(TMPP)Cl)和Ir(dFCF3ppy)2dttbpyPF6 进行催化。这一初始反应提供了关键的概念验证,即通过自由基的方式制备卡宾中间体是一种可行的策略;经过优化,所需的环丙烷化产物的产率为95%。对照实验表明所有反应组分都是必要的,在没有铁催化剂、光或Hantzsch酯的情况下,不会形成任何产物。在没有铱光催化剂的情况下,效率降低(36%),这与Hantzsch酯介导的电子供体-受体复合物用于自由基生成一致。
在确定了该环丙烷化工艺的可行性,并掌握了初始最佳条件后,作者探索了可用于铁卡宾形成的离去基团的范围。合成了乳酸衍生物的NHPI酯,该酯具有一系列非传统α-含氧离去基团:α-苯氧基、α-甲氧基和α-羟基。在为 α-乙酰氧基系统确定的优化条件下,所有这些底物环丙烷化顺利进行,产率为 77-95%。对甲苯磺酰基和三氟甲磺酰基保护的α-氨基酸以良好的产率生成所需的环丙烷化产物。作者还鉴定出六种能够作为卡宾前体的不同离去基团,证明了铁卟啉α-消除对各种离去基团能力的耐受性(范围超过10个pKa 单位),并提供了一种模块化策略来获取卡宾中间体(图1b)。
在掌握了优化的环丙烷化条件后,作者探索了羧酸和烯烃的范围。由α-乙酰氧基羧酸生成的苄基和烷基卡宾都是有效的配偶体(图 2)。苯乙烯(1)和富电子烯烃 (2-4)顺利进行了环丙烷化,苄基氨基甲酸酯(CBz)保护的脱氢丙氨酸以中等产率环丙烷化(5),揭示了一种温和而简便的肽骨架修饰方法。重要的是,带有一系列功能团的复杂骨架可以进行有效的金属光氧化还原环丙烷化,证明了该方法适用于后期功能化(6-8)。传统上,由于竞争性氧化,叔胺在光氧化还原条件下存在问题,但添加一当量的三氟甲磺酸来质子化胺(7),叔胺的耐受性良好。对α-甲氧基和 α-苯氧基羧酸范围的探索再次表明,一系列取代的卡宾和烯烃在反应条件下表现良好,包括那些含有药用相关杂芳环的卡宾和烯烃(9-15)。几种氨基酸经历了卡宾形成,甲磺酰基保护的丙氨酸、蛋氨酸亚砜、亮氨酸和赖氨酸可作为可行的卡宾前体(16-19)。可以使用自由基前体和烯烃偶联配偶体的多种衍生物来获得各种各样的环丙烷化骨架。
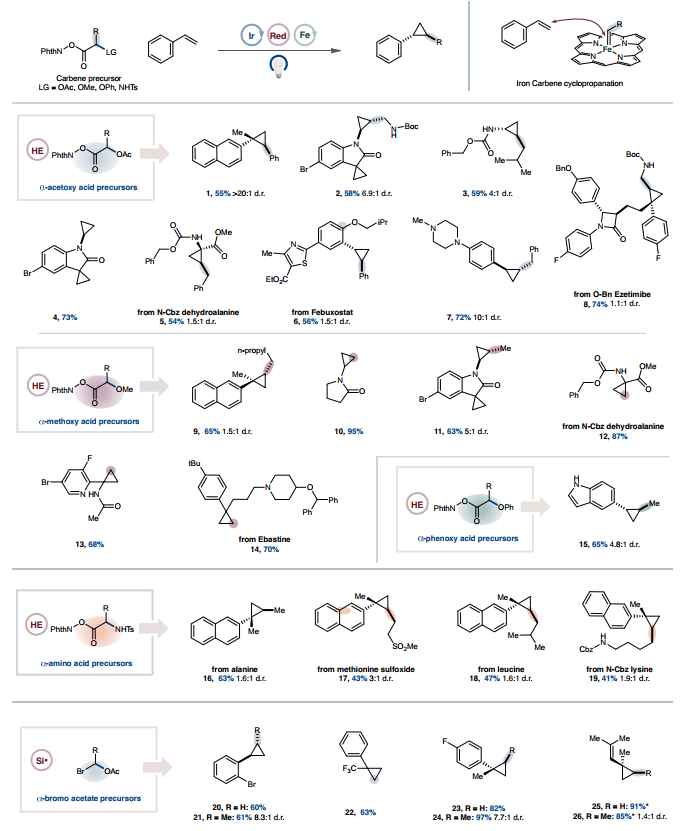
图2. 以羧酸为前体的光氧化还原铁卡宾环丙烷化范围
图片来源:Nature
鉴于自由基与金属中心的结合与自由基的起源无关,作者想知道这种模式是否可以扩展到羧酸衍生的自由基前体以外的其他自由基前体。早期研究支持这种方法的普遍性,可以通过硅基自由基介导的卤素原子提取(XAT)来使用市售或由相应醛轻松生成的α-溴乙酸酯。在这种烷基自由基物种金属化后,受控的α-消除会生成卡宾中间体,而卡宾中间体又很容易进行环丙烷化(20-26)(图2,底部)。这一发现鼓励作者探索其他卡宾前体,这些前体如果通过其他方式制造会很困难甚至很危险。使用易于获取的2,2,2-三氟乙基化NHPI醚,环丙烷化在使用苯乙烯基衍生物(包括未保护的吲哚(29)和羧酸(30)的衍生物)时顺利进行(图3),表明对酸性官能团具有耐受性,而使用传统的卡宾前体由于其叶立德型特性而存在问题。在前面描述的酸性质子化策略下,游离胺是可以耐受的(31)。含有α-酯官能团的缺电子苯乙烯以良好的产率进行环丙烷化(32),二烯成功转化为烯丙基三氟甲基化环丙烷(33)。尿嘧啶衍生的烯酰胺只与富电子烯烃发生反应(34),这与亲电性铁卟啉卡宾反应性一致。
苯胺和Cbz保护的胺在反应中耐受性良好,可生成氨基环丙烷产物(35-37)。合成难度较低的环丙烷,如羟基环丙烷等价物,也可以通过苯甲酸乙烯酯获得(38)。药物化合物和复杂的类药物骨架以高产率环丙烷化,表明该方法具有高官能团耐受性,并具有应用于后期官能化的潜力(39-46)。使用2,2-二氟乙醇作为起始原料也同样有效,可生成中等产率的二氟甲基取代环丙烷(47-51)。通过在还原条件下利用 β-氟NHPI活化醇的酮基型裂解,在温和的反应条件下获得了难以捉摸的二氟甲基化和三氟甲基化环丙烷。
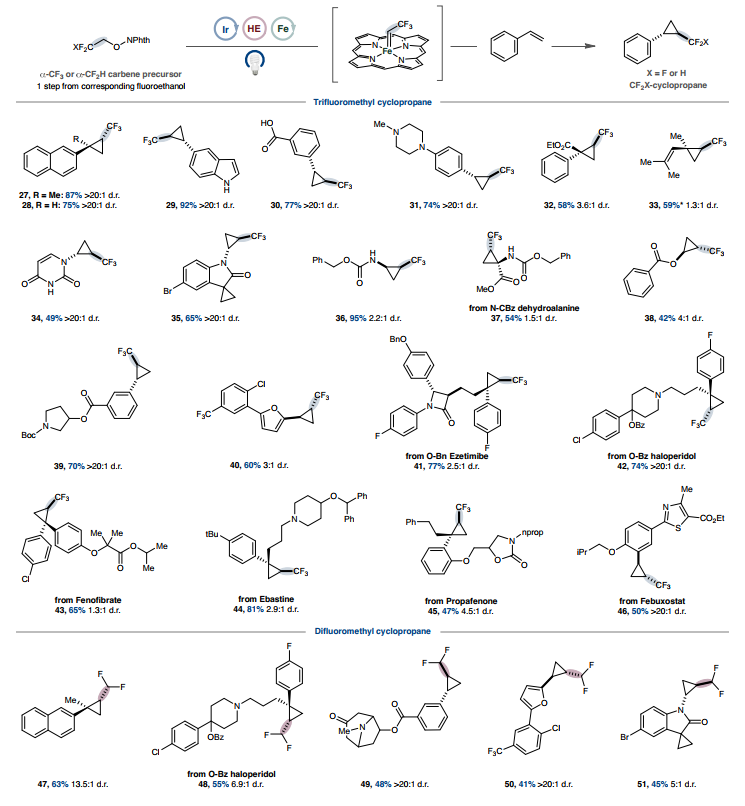
图3. 通过卡宾金属光氧化还原进行三氟甲基和二氟甲基环丙烷化的范围
图片来源:Nature
除了环丙烷化之外,铁卡宾还因其Fischer型卡宾特性而发生σ-键插入反应。这种反应性提供了另一种潜在途径来利用通过金属光氧化还原产生的瞬态卡宾,同时验证铁卡宾在此平台中的中介性。β-氟醇和羧酸基系统成功插入P-H 键(图4、52和53)。将这种反应性扩展到苯硫酚起始原料可以合成(二氟)烷基化硫醚产物(54和 55)。此外,苯胺和胺的N-H烷基化反应顺利进行,包括在含有具有重要医学价值的缺电子杂芳烃的骨架上(56-59)。通过与NHPI活化的α-苯氧基丙酸反应获得单烷基化胺产物,从而绕过了酰胺键形成的常规反应性(60)。在这些不同环境中成功实现σ-键插入,进一步揭示了卡宾中间体除了成环外还能参与有用的键形成,并确立了它们作为反应性中间体的威力,可以通过本文的自由基方法有效利用。
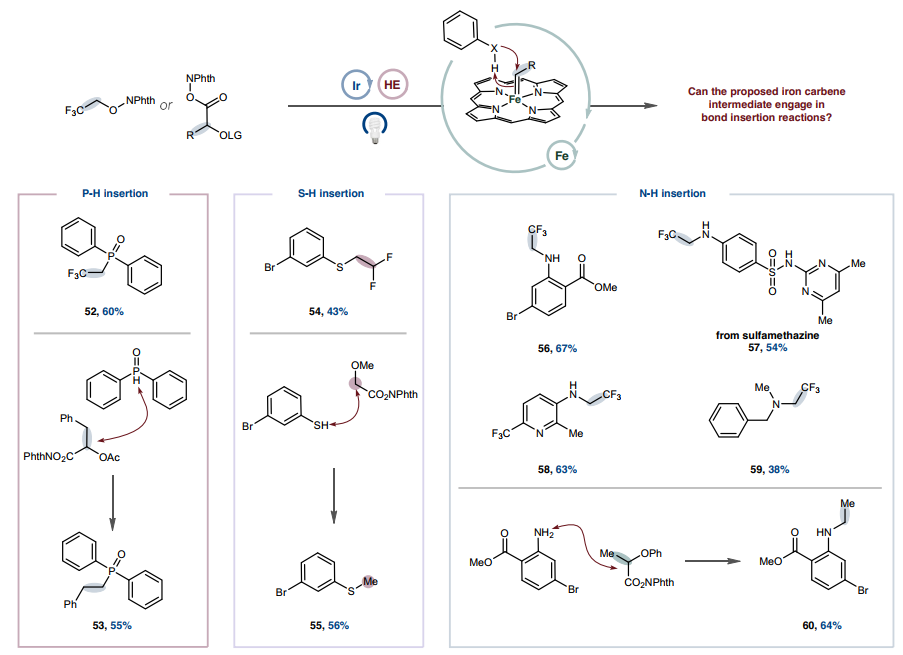
图4. 通过金属光氧化还原卡宾形成σ-键插入
图片来源:Nature
总结
MacMillan教授课题组报道了一个概念上全新的平台,通过将铁催化与光氧化还原催化相结合来有效地获取高能卡宾。在可见光的能量下,稳定且普遍存在的起始原料(如羧酸、氨基酸和醇)很容易转化为铁卡宾中间体。这种方法克服了使用常规方法获取卡宾反应性的固有局限性,并在金属光氧化还原条件下,使用六种未充分探索的离去基团,从稳定起始原料中释放出它们作为反应中间体的潜力。该方法的实用性体现在可以通过环丙烷化和σ-键插入获取的各种骨架上。本文的方法显示了光化学反应特有的广泛复杂性容忍度,将成为一种新的卡宾生成机制方法和一种利用卡宾反应性来增强分子复杂性的强大合成工具。
文献详情:
Unlocking carbene reactivity by metallaphotoredox α-elimination.
Benjamin T. Boyle*, Nathan W. Dow, Christopher B. Kelly, Marian C. Bryan & David W. C. MacMillan.2024







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国