导读
近日,2021年诺贝尔化学奖得主、美国普林斯顿大学默克催化中心(Merck Center for Catalysis at Princeton University)David W. C. MacMillan课题组发展了一种铜金属光氧化还原策略,实现了醇与N-亲核试剂的开壳脱氧偶联,构建了C(sp3)-N键。利用此策略可以实现具有高价值的药物的合成,而这利用传统的交叉偶联过程通常难以实现。反应首先经历了氮杂环卡宾(NHC)介导的醇转化为相应的烷基自由基,随后通过铜催化的C-N偶联实现转化,该反应对一系列醇和N-亲核试剂均具有良好的兼容性。相关成果发表在J. Am. Chem. Soc.上。
诺奖得主最新Nature:“铁催化+光氧化还原催化”协同助力全新的卡宾化学
(图片来源:J. Am. Chem. Soc.)
正文
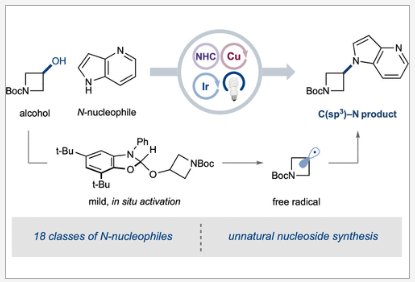
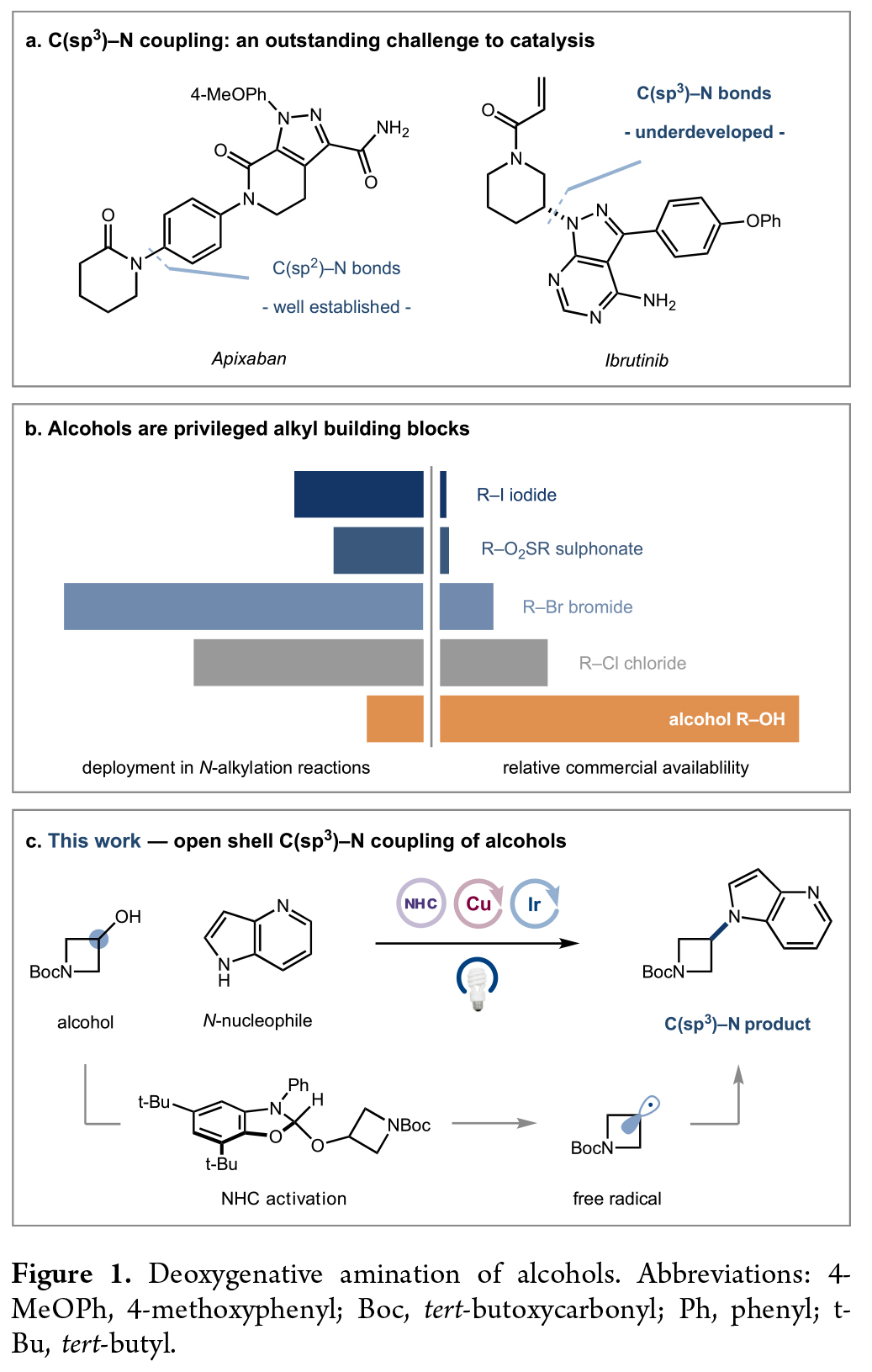
碳氮键广泛存在于药物、农用化学品、天然产物和功能材料中。在FDA批准的小分子药物中超过80%含有至少一个氮原子,并且在药物发现阶段18%的合成转化涉及C-N键的构建。过去二十年来,C(sp2)-N键的构建取得了巨大进展,这主要归功于强大的过渡金属催化策略的发展,如Buchwald-Hartwig偶联, Ullman-Goldberg偶联和Chan-Evans-Lam偶联反应。尽管已经取得了一定的进展,但发展一个高效、通用的合成方法来实现医药相关的C(sp3)-N键的构建仍然具有很大的需求(Figure 1a)。
醇是一种简单易得且结构多样的天然烷基合成砌块(Figure 1b)。其在药物和天然产物中的广泛存在为分子的直接后期官能团化提供了机会。然而,目前利用醇作为烷基化试剂的转化却有待进一步探索。由于C(sp3)-O键的低亲电性和固有强度,醇必须首先转化为更具反应性的物种才能继续转化,而这些活化过程通常需要时间和多步反应,且在纯化过程中具有很大的挑战性。美国普林斯顿大学默克催化中心David W. C. MacMillan课题组发展了一种铜金属光氧化还原策略,实现了醇与N-亲核试剂的开壳脱氧偶联,从而构建了C(sp3)-N键(Figure 1c)。
(图片来源:J. Am. Chem. Soc.)
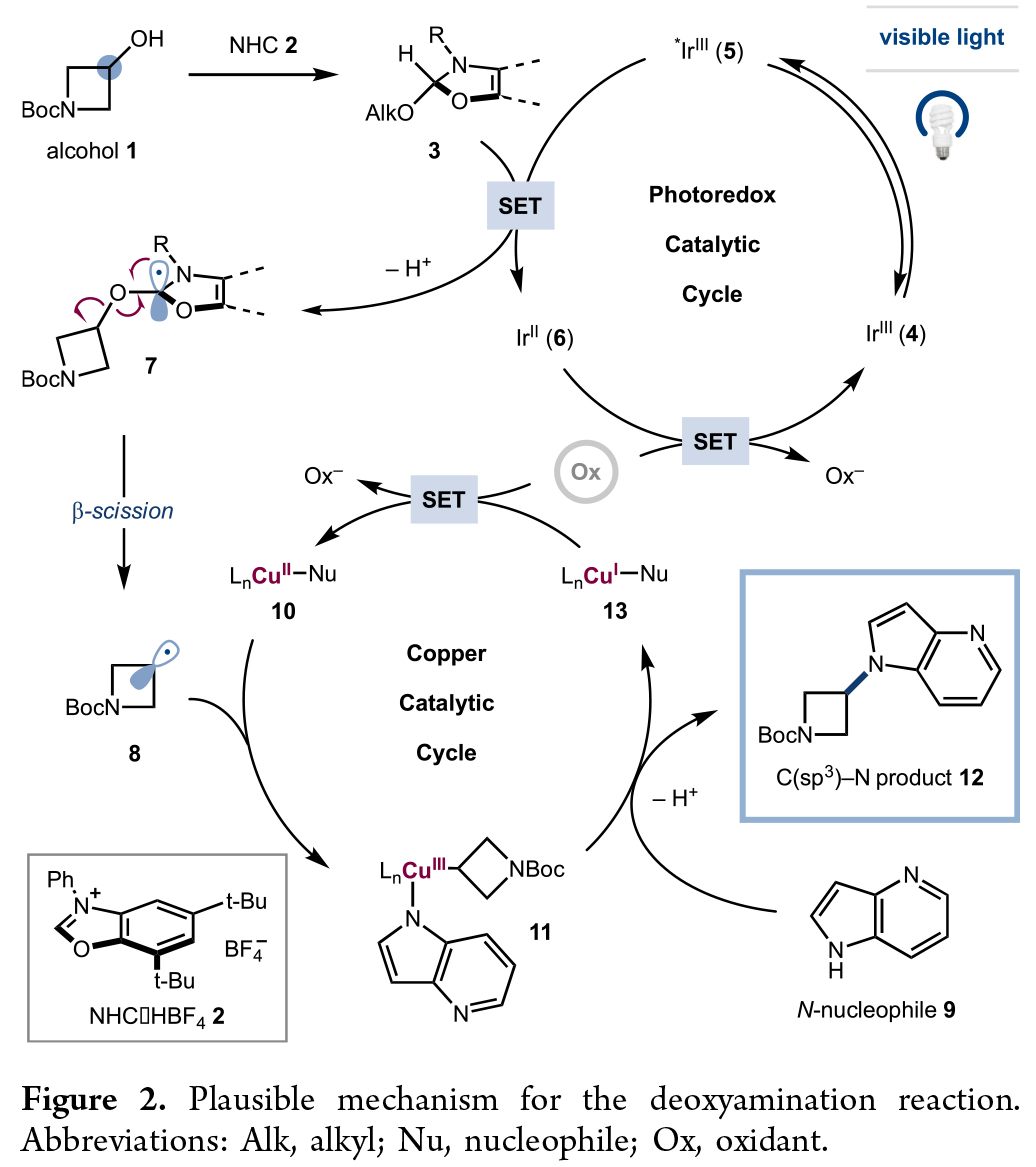
此C(sp3)-N交叉偶联反应的可能机理如Figure 2所示:首先,醇1与N-芳基苯并噁唑盐2在温和碱性条件下反应,生成NHC -醇加合物3。在可见光(450 nm)光激发下,[Ir(Fmppy)2(dtpy)][PF6]配合物4 形成了长寿命的三线态激发态(τ = 1.2 μs)。这种光激发的*Ir(III) 5 (E1/2red [*IrIII/IrII] = +0.94 V)很容易被NHC-醇加合物3通过单电子转移(SET) (E1/2 = 1.0 V)淬灭,产生还原的Ir(II)物种 6和自由基阳离子加合物。该自由基阳离子中的次甲基C-H键可以被化学计量的碱去质子化,生成α-氧自由基7。接下来,7经历C-O键的β-断裂,得到无反应性的氨基甲酸酯副产物和游离的烷基自由基8。此外,N-亲核试剂9与醋酸铜(II)和化学计量的碱反应生成Cu(II)氨基配合物10。配合物10以接近扩散速率捕获游离的烷基自由基8,并生成假定的Cu(III)烷基中间体11。高价铜配合物11经过还原消除产生C(sp3)-N偶联产物12和低价铜(I)物种13。最后,两个催化循环通过外源化学量氧化剂与还原的铱催化剂6 (E1/2red [IrIII/IrII] = -1.50 V)和铜催化剂13反应进行循环。
(图片来源:J. Am. Chem. Soc.)
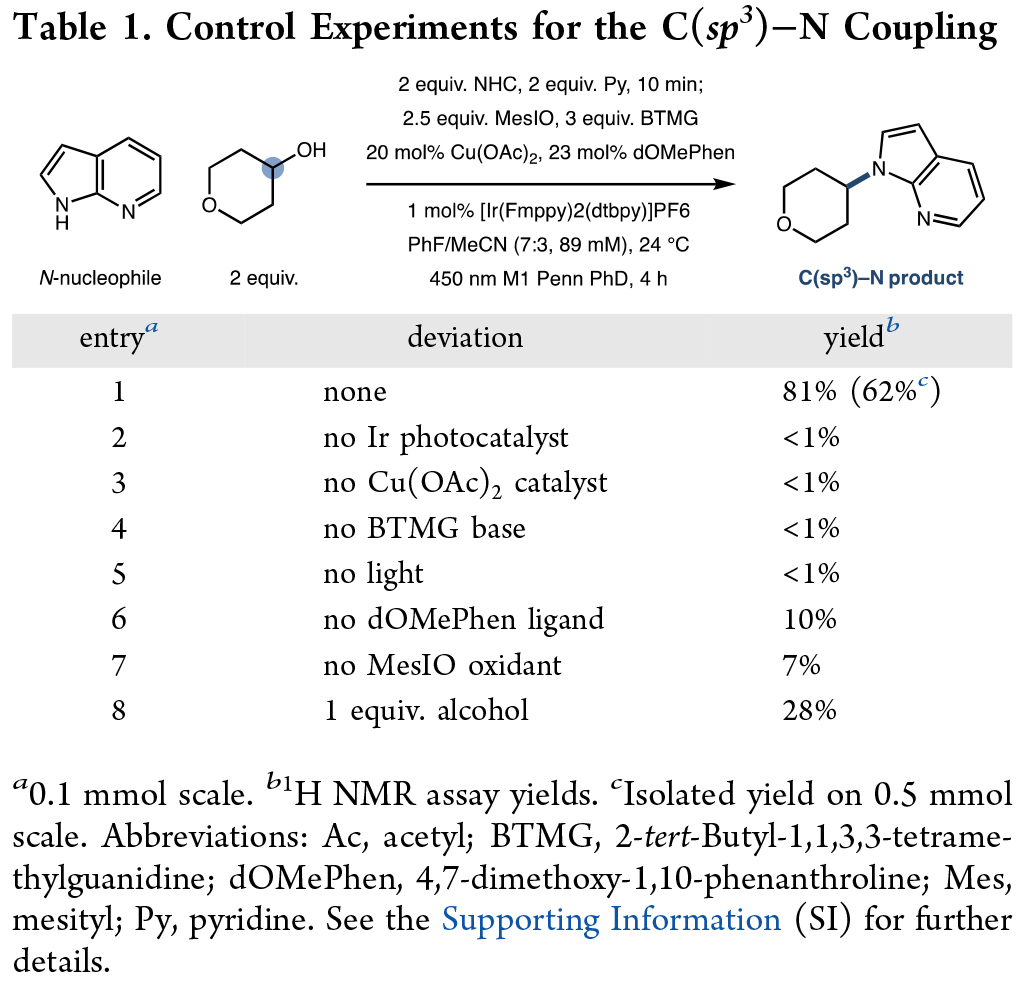
首先,作者使用7-氮杂吲哚和4-四氢吡喃醇作为模板底物对此转化进行了探索,并对反应条件进行了优化(Table 1)。当使用7-氮杂吲哚 (0.10 mmol, 1.0 equiv), 4-四氢吡喃醇 (2.0 equiv), NHC (2.0 equiv), 吡啶 (2.0 equiv)反应10分钟,随后加入MesIO (2.5 equiv), BTMG (3.0 equiv), Cu(OAc)2 (20 mol%), dOMePhen (23 mol%), [Ir(Fmppy)2(dtbpy)][PF6] (1 mol%)在PhF/MeCN (7:3, 89 nm)中, 450 nm 光照下,24 oC反应4小时可以以81%的核磁产率得到相应的C-N偶联产物(entry 1)。此外,当将此转化放大至0.5 mmol规模时,仍可以以62%的分离产率得到产物。控制实验表明,在没光催化剂、铜盐、碱以及光引发的条件下均不能得到产物(entries 2-5)。当不使用配体或氧化剂以及降低醇的用量为1当量时产率均有所降低(entries 6-8)。这些结果与推测的反应机理相一致。
(图片来源:J. Am. Chem. Soc.)
在得到了最优反应条件后,作者对此转化的底物范围进行了考察。首先,作者对18类不同的药物相关氮亲核试剂的兼容性进行了考察(Table 2)。实验结果表明,包括吲哚(14, 70%; 15, 71%)、氮杂吲哚(16-18, 61-81%)、吡咯(19, 62%)、咔唑(20,77%)、氮杂咔唑(21, 65%)、咪唑(22,53%)、苯并咪唑(23,61%)、吡唑(24, 72%; 25, 74%)、吲唑(26-28, 68-78%)、氮杂吲唑(29, 63%; 30, 61%)、三唑(31, 67%; 32, 57%)、酰胺(33-35, 60-74%)、苯胺(36, 79%; 37, 77%)、亚胺(38,69%)、氨基甲酸酯(39,79%)等均可兼容。此外,此转化对一系列生物活性分子同样具有良好的兼容性,如Skelaxin (40, 61%), procaine (41, 42%)和Carvedilol (42, 42%)。
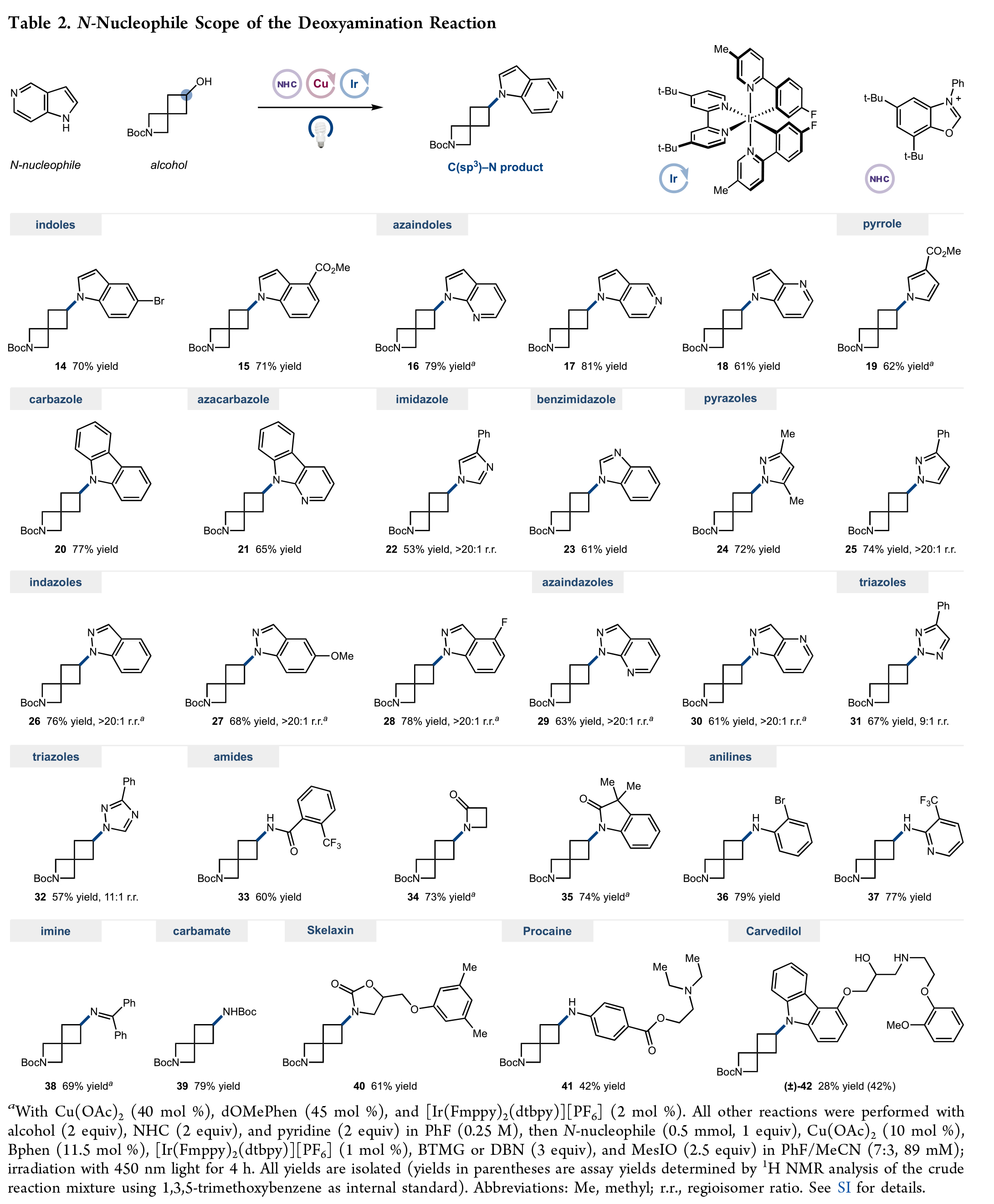
(图片来源:J. Am. Chem. Soc.)
接下来,作者对醇的兼容性进行了考察(Table 3)。实验结果表明,一系列伯醇和仲醇均具有良好的兼容性,以36-75%的产率得到相应的偶联产物43-60。值得注意的是,利用此策略还可以实现广泛应用于抗癌和抗病毒治疗的非天然核苷的合成,以63-78%的产率得到相应的产物61-65,进一步证明了此转化的实用性。
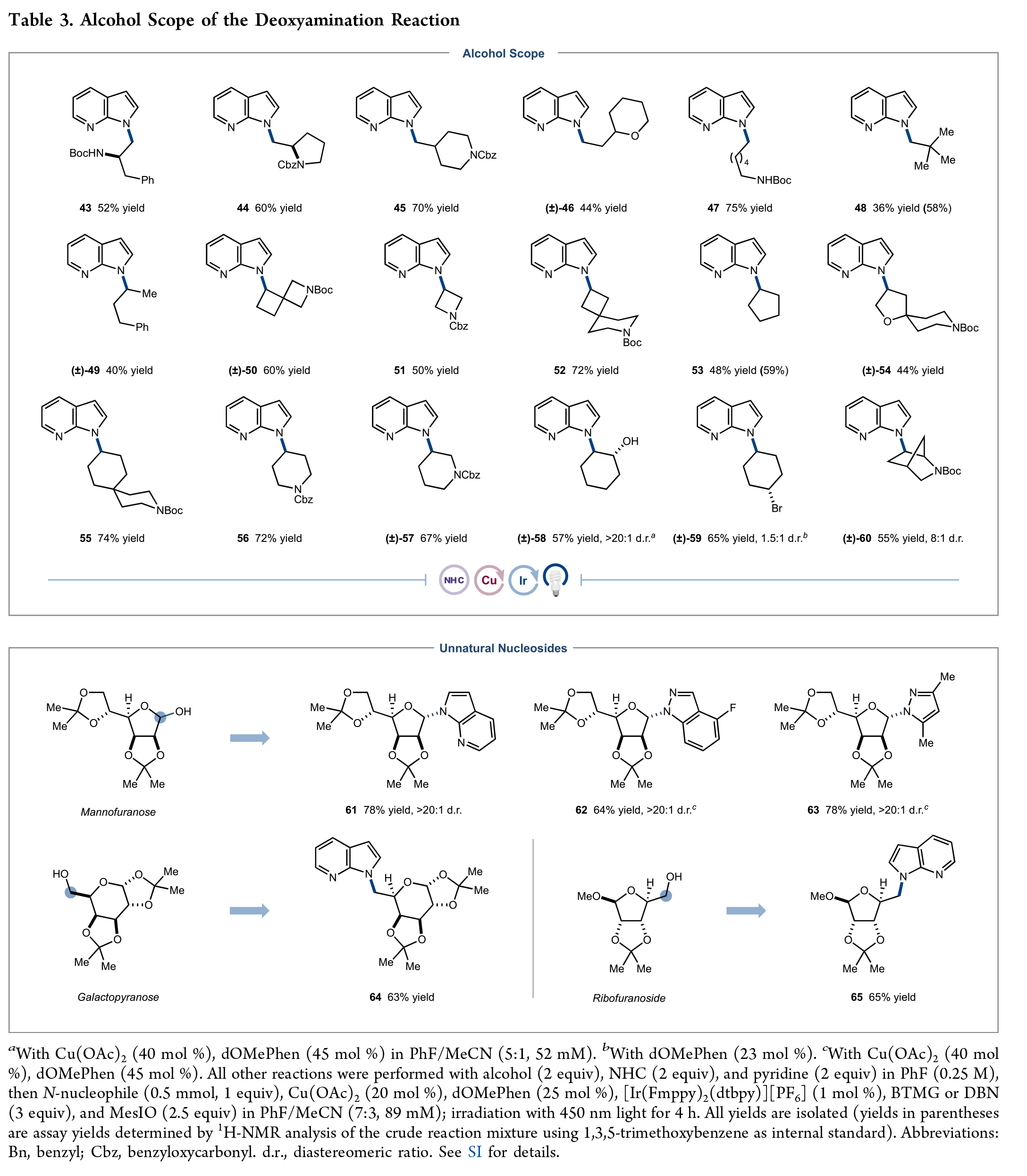
(图片来源:J. Am. Chem. Soc.)
总结
David W. C. MacMillan课题组发展了一种有效的合成策略实现了铜金属氧化还原催化N-亲核试剂与简单醇的烷基化反应。此转化具有广泛的底物范围,包括含氮杂环、苯胺、酰胺、伯醇和仲醇、二醇、单糖和复杂的药物分子等均可兼容。鉴于C(sp3)-N键在生物活性分子中的重要性,预计该反应将在药物化学界得到广泛的应用。
文献详情:
Free-Radical Deoxygenative Amination of Alcohols via Copper Metallaphotoredox Catalysis.
William P. Carson II,Artem V. Tsymbal, Robert W.
Pipal, Grant A. Edwards, Joseph R. Martinelli, Albert Cabré, David W. C. MacMillan.
J. Am. Chem. Soc., 2024,







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国