
前言概述
/ CONTENTS
学科新知聚焦业内权威专家,从学科发展的高度全面梳理、深入解读肿瘤医学各领域的国内外研究现状与进展,为医护以及科研人员立体勾勒恶性肿瘤领域的最新研究进展,赋能临床科研和学术推广,为医学研究者搭建一个共享知识、交流经验的平台,推动肿瘤医学领域的国际化合作与发展。
本期学科新知分享的是中南大学湘雅医院傅敢教授对淋巴瘤临床前沿进展的精彩解读。
TP53基因的畸变和p53蛋白通路的失调在许多人类肿瘤的发病机制中很重要,特别是弥漫性大B细胞淋巴瘤。通过调节许多下游靶基因或分子,TP53主要可以抑制肿瘤生长,并促进细胞DNA修复、凋亡、自噬、细胞周期停滞、信号传导、转录、免疫或炎症反应和代谢。TP53的功能障碍,包括microRNA调控、TP53通路和TP53本身的拷贝数改变、TP53调节因子失调以及TP53功能模式异常导致的体细胞突变,在淋巴瘤的发生、进展和侵袭中起重要作用,具有该突变的弥漫大B细胞淋巴瘤患者的预后往往不佳[1]。本文讨论TP53突变对弥漫大B细胞淋巴瘤患者预后的影响,展望未来TP53突变阳性弥漫大B细胞淋巴瘤临床探索方向,共同推进中国淋巴瘤临床治疗事业的发展!
1
p53蛋白的复杂作用
(1)p53——8亿年的进化
人类p53家族包含三个成员p53、p63和p73。TP53基因家族在多细胞动物发育过程中已经进化了6亿至8亿年,其编码的p53蛋白及其细胞通路通过对环境扰动的感知、调节,在胚胎发育过程中起着重要作用,通过细胞凋亡等途径确保多细胞生物各细胞类型间的协调与稳定,有着丰富而强大的功能[2, 3]。
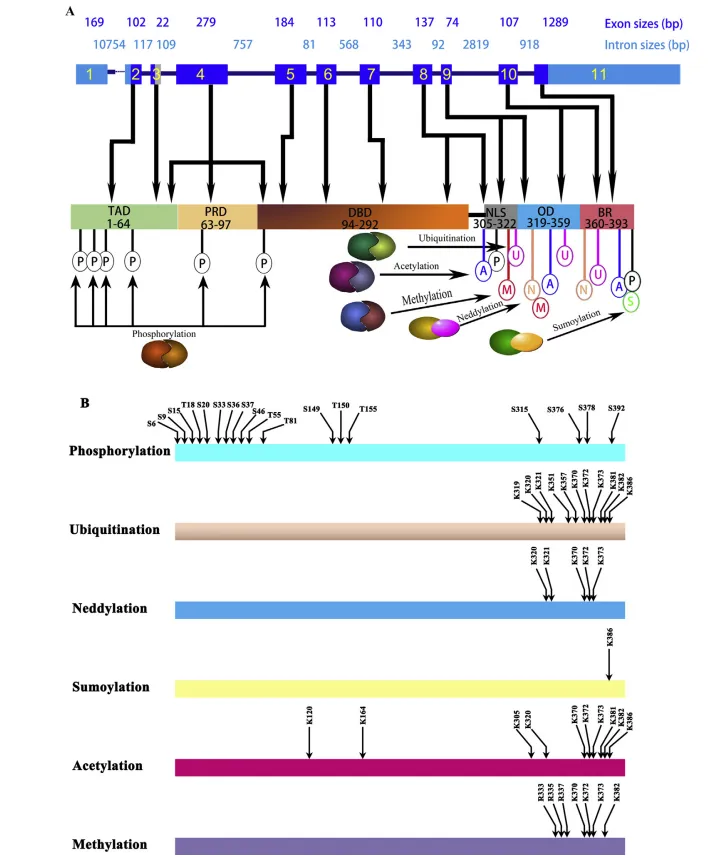
图1 TP53和p53蛋白的结构[1]
p53可以感知并响应表观基因组扰动,参与调控发育过程中满足特定生物学需求基因的表达。例如,DNMT和TET等表观遗传调控蛋白对DNA甲基化的严格调控就需要p53参与[4]。
p53还可以帮助维持基因组完整性,其中一个机制就是抑制逆转录转座子的活性。LINE-1是目前已知的在人体内唯一能够自主性转座的逆转录转座子,其高表达与肿瘤的发生发展密切相关[5, 6]。
p53在DNA损伤修复、诱导细胞衰老和促进细胞凋亡过程中起到关键作用。当DNA受损时,p53被激活以促进受损细胞的清除或修复,降低它们突变的积累风险。值得注意的是,p53对于可逆DNA损伤诱导的G1期检查点至关重要,这主要是通过其转录激活p21周期蛋白依赖性激酶抑制剂基因来介导的[5]。
此外,p53在抑制肿瘤血管形成、维持代谢稳态等方面也展示出强大实力[5]。
正是由于p53的多重功能,它被视为“基因组的守护者”,致力于维持多细胞生物体内细胞功能和组织结构的协调性,并在抑制肿瘤方面发挥着巨大潜力[1, 5]。
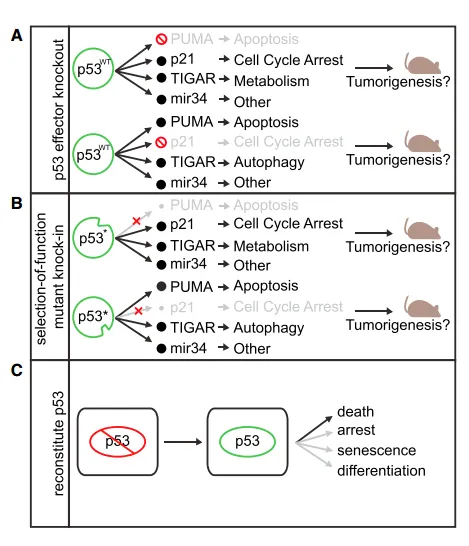
图2 p53肿瘤抑制机制的研究[5]
(2)p53调控网络
p53和MDM2蛋白是该通路中的中心枢纽。在正常细胞中,p53蛋白通过包括MDM2在内的一系列调节因子维持在低水平,MDM2作为p53泛素连接酶,促进其降解,抑制p53下游调控的相关基因表达。细胞环境(细胞类型、表观遗传状态、组织微环境、激活信号)对p53活性的生化方面以及p53反应的生物学结果都至关重要,多种多样的调控因子控制着p53的活性,而p53反过来又控制着许多不同的生物学过程,其各种功能取决于其控制众多靶基因中不同组的能力。正因如此,p53嵌入在一个密集且相互连接的调控网络中[5]。
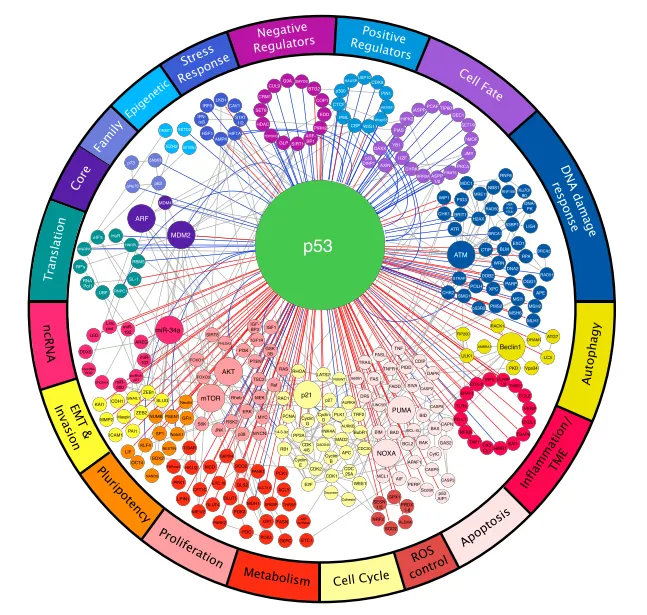
图3 p53调控网络[5]
2
TP53突变类型及成药
p53蛋白具有复杂的功能,TP53位点的改变也具有多样性。由于TP53突变往往导致p53失活,恢复p53的功能比较困难,因此直接靶向p53被认为是不可成药的。但是,针对p53调控网络的靶向治疗目前正被广泛研究。另外,针对p53特定突变的免疫疗法、合成致死策略等可能是未来的重要研究方向。
01
TP53突变的多样性
在TP53基因的改变中,缺失、插入、移码、错义和无义突变构成了其主要的发生机制。尤其是错义突变,它在这些变化中显得尤为普遍。据研究报道,在多达200余种的人类实体肿瘤中,有大约一半的肿瘤携带了TP53基因突变。目前的大部分观点将p53分为野生型和突变型,但TP53突变是以不同的模式发生的,其在许多等位基因配置中产生多样的功能和表型分支。例如,野生型功能的衰减可以产生亚型,也可以根据p53抑制的水平产生不可预测的和质量不同的表型。随着未来临床决策越来越多地基于基因组数据,简单地将肿瘤分类为“p53野生型”或“p53突变型”可能会忽略突变的复杂性[5]。
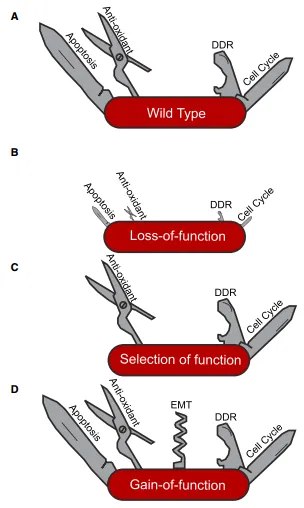
图4 几种不同的机制可导致不同的p53突变表型[5]
02
p53相关靶向抗肿瘤药物治疗
在肿瘤治疗领域,寻找能够有效靶向突变p53蛋白的药物一直是科研人员不懈追求的目标。然而,这一努力却面临着不小的挑战。由于野生型p53蛋白以及大多数突变p53蛋白缺乏明确的结合口袋或变构位点,这使得传统药物设计策略难以应用。因此,这些p53蛋白往往被视为“不可成药的”靶点,尽管如此,科研人员仍在努力探索新的药物设计思路和技术手段,以期突破这一难题,为肿瘤患者带来更有效的治疗方案。
● 抑制野生型p53蛋白的降解
在保持野生型TP53表达的肿瘤中,最广泛采用的p53靶向治疗方法是抑制p53降解。现有的研究表明,p53的降解机制与E3泛素连接酶MDM2密切相关,MDM2通过使p53泛素化,进而引发p53的蛋白酶体降解。值得注意的是,MDM2的扩增现象在多种癌症类型中均有发现,尤其常见于保持野生型p53的肿瘤中。MDM2介导的泛素化和降解依赖于它与p53的直接结合,这启发了科研人员积极寻找能够抑制MDM2与p53结合的小分子化合物,以此作为稳定p53并恢复其抗肿瘤效力的新手段。例如,APG-115、AMG-232等[7]。
● 靶向截断的p53蛋白
尽管错义突变在肿瘤相关的TP53突变中占据多数,但仍有大约10%的TP53突变肿瘤携带着无义突变,这些突变导致产生截断蛋白。这些截断蛋白由于结构不完整,通常在翻译后不久便被无义介导的mRNA衰变(NMD)机制所降解。鉴于这些蛋白质的存在时间极短,且往往缺乏完整的p53蛋白序列,研究人员提出了两种替代策略来激活含有p53截断突变的癌细胞中的p53信号通路[7]。
第一种策略是通过利用能够促进翻译读通的分子,让翻译机制越过RNA中的停止密码子,从而合成全长p53蛋白。例如,G418、NB124等。另一种互补的策略则聚焦于抑制NMD过程。这两种方法为TP53无义突变的肿瘤患者提供了新的治疗思路[7]。
● 基于p53蛋白的免疫治疗
近年来,肿瘤免疫治疗方案的突破性进展在多种肿瘤类型中取得了显著的成果,激发了研究者们对于基于p53免疫治疗策略的研究热情。这些策略的核心目标在于提高免疫系统的识别和清除能力,有望为肿瘤患者提供更加个性化和高效的治疗方案,为肿瘤治疗领域带来新的希望和突破。例如,p53疫苗、T细胞受体模拟(TCRm)抗体等[7]。
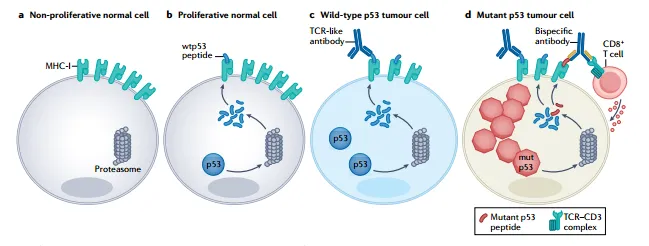
图5 癌细胞中p53的抗体新策略[7]
● 基于p53蛋白的基因治疗
基因治疗作为恢复p53功能的关键手段,其重要性不容忽视。值得一提的是,首个获批用于临床实践的基因疗法便是以p53为基础,即重组腺病毒人p53(rAd-p53)注射剂Gendicine,用于治疗头颈鳞状细胞癌(HNSCC)。这一里程碑式的成就不仅彰显了基因治疗在医学领域的巨大潜力,也为后续更多基于p53的基因疗法研究与应用提供了宝贵的经验[7]。
此外,在非病毒载体递送策略的设计上,纳米技术的巧妙应用显著提升了基因的转染效率,增强了其特异性,并改善了生物相容性。非病毒载体的基因类型丰富多样,其中主要包括寡核苷酸、质粒DNA以及siRNA等。例如,在肝细胞癌小鼠模型中,p53 mRNA纳米颗粒联合免疫治疗比单独治疗具有更好的抗癌效果,这一发现为进一步深入探索p53 mRNA与免疫检查点阻断治疗联合应用的疗效奠定了坚实的基础[7]。
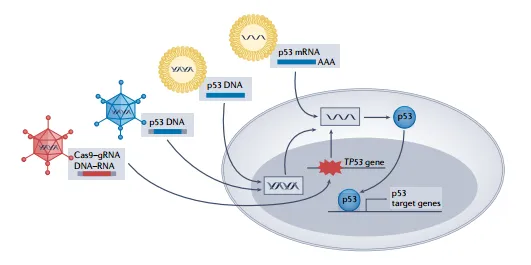
图6 基于p53蛋白的基因治疗[7]
3
弥漫大B细胞淋巴瘤患者中TP53基因异常对预后的影响
弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤中最常见的类型,具有高度的异质性和高侵袭性。DLBCL的发病过程涉及多种相关基因的异常,这些异常不仅参与了疾病的发生,还深刻影响着患者的预后。
有研究显示,21.4%的DLBCL患者伴有p53基因突变,其中90.2%为单一核苷酸突变,9.8%为其他突变;TP53功能障碍在DLBCL的发生、发展和进展中的重要作用已获得大量证据支持。Kaplan-Meier分析结果显示,p53基因突变患者的预后明显差于无突变者,是DLBCL患者的独立预后因素[8]。但是由于TP53基因突变及其突变后功能变异的多样性、异质性,其对某个具体患者预后影响的分析应该结合该患者TP53基因突变的类型、位点、受影响的靶基因等而进行个体化分析、“case by case”,传统的简单根据p53基因变化状态“野生型或突变型”而笼统地分为 “预后好、预后差”的观点是不精确的,如在2020年提出的一种DLBCL分子分型中,p53突变对预后的影响在不同分子亚型之间差别很大:在MYD88和bcl⁃2亚型中,p53突变提示预后不良;在Notch2或SOCS1/SGK1亚型中,p53突变对预后无明显影响;而在TET2/SGK1亚型中p53突变罕见[9]。
单核苷酸多态性(SNP)作为DNA序列中单个核苷酸变异的遗传现象,其数量最为丰富。而体细胞单核苷酸变异(SNV)作为SNP的一种具体形式,在肿瘤的发生机制中扮演着关键角色。2014年,British Journal of Haematology刊文指出,TP53不同突变体导致患者对R-CHOP响应不同,该研究发现TP53基因rs1625895多态性的G/G基因型与DLBCL患者R-CHOP治疗失败的高概率相关[10]。另一项研究发现,在接受R-CHOP治疗的DLBCL患者中,位于TP53 3’-UTR的新发SNV改变了TP53的RNA和蛋白质水平。具体来说,这些新发SNV的存在破坏了miRNA与3’-UTR的结合,降低了miRNA抑制作用,从而增加了p53蛋白水平。然而,新发SNV对DLBCL患者预后的影响取决于TP53 CDS、WT或MUT的状态。在WT-TP53的情况下,与没有新发SNV的患者相比,miRNA抑制减少,WT-TP53表达增加,患者预后改善;而在MUT-TP53的情况下,无论是否存在新发SNV,MUT-TP53的表达量都会增加,这可能导致化疗耐药和预后较差。大约50%的DLBCL患者含有3’-UTR新发SNV,预计这些新发SNV会破坏miRNA结合位点。因此,在预测患者治疗后的预后方面,相比仅依据TP53状态进行预测,将新发SNV与TP53状态综合考虑能够提供更为全面和准确的信息[1]。

图7 miRNA调控TP53对预后的影响[1]
4
伴TP53突变的弥漫大B细胞淋巴瘤患者对不同治疗方案的响应
目前DLBCL的标准一线治疗方案是6~8周期R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松),对于携带TP53基因突变的DLBCL患者而言,由于标准的R-CHOP治疗不能克服TP53突变的不良预后,为了改善这部分患者的预后状况,寻找更为有效的治疗方案成为当前研究的重点。
现有数据表明,增加R或周期数作为一种治疗强化方式,都不会影响TP53突变患者组的预后。2022年一个意大利的多中心协作组尝试了增加常规化疗强度(DA-EPOCH-R+HD-MTX、未行自体干细胞移植)对双表达或双打击伴TP53基因突变DLBCL患者疗效的单臂研究,临床试验观察到增加治疗强度后2年OS似乎比既往临床研究报道的R-CHOP方案2年OS有明显提高,2年OS可以达到62%,但对比无TP53基因突变(2年OS:88%,P=0.036)仍有显著差异,提示单纯加大常规药物剂量不能克服TP53基因突变对预后的负面影响[11]。
2021年发表的FIL-DLCL04临床研究(R-CHOP/R-megaCHOP对比R-CHOP+HDC+ASCT/R-megaCHOP+HDC+ASCT)随访72个月后发现5年FFS(TP53 基因突变 vs TP53野生型为24% vs 72%)和5年OS(TP53 基因突变 vs TP53野生型为34% vs 83%),说明在年轻DLBCL患者中,哪怕部分患者接受了自体干细胞移植,TP53基因突变也是一个独立不良预后因素。这项研究也发现,TP53突变患者与TP53 WT患者相比,接受高剂量化疗加自体干细胞移植的强化治疗,FFS与OS无差异;但由于此研究实验设计中并没有预设TP53 基因状态分层、同时整体样本数偏少、TP53 基因突变在整体入组人群中也只占比9%,因此并不能改变自体干细胞移植很可能不能克服TP53基因突变对预后的负面影响的观点[12]。
由于目前直接针对TP53基因异常的药物研究进展还未进入临床,在国内外,诸多临床研究都积极聚焦于探索如何利用已有的新药结合不同药物组合的治疗方案以期对TP53突变型DLBCL患者的预后产生积极影响,“R-CHOP+X”方案是其中的一个重要探索点。
由于Phoenix和Robust研究中未设置TP53基因突变亚组分层,目前来说伊布替尼和来那度胺对TP53基因突变的影响尚不明确,但由于这两个临床试验对于non-GCB和/或ABC subtypes DLBCL患者均未获益,普遍认为前景不乐观,有可能需要更有效的BTK抑制剂或免疫调节剂来进行专门的临床试验。2023年12月ASH年会上,华中科技大学同济医学院附属同济医院肖毅教授团队分享了奥布替尼联合R-CHOP方案(OR-CHOP)治疗初治TP53突变DLBCL患者的单臂研究结果,基于OR-CHOP的方案在TP53突变的DLBCL患者中具有良好的抗肿瘤活性和可控的安全性(12个月PFS率为80.0%,12个月OS率为75.0%)[13]。评判其他新药(如Bcl-2抑制剂、XPO-1抑制剂、mTOR抑制剂、有丝分裂抑制剂等)是否对TP53基因突变患者预后产生影响的研究也有散在报道,但基本都是小样本回顾性分析、缺乏大规模前瞻性对照研究,总体上来讲结论尚不确定、前景也不乐观,但借鉴从慢性淋巴细胞白血病和套细胞淋巴瘤临床试验中获得的部分数据,含BTK抑制剂和Bcl-2抑制剂的联合方案有可能值得关注。
在2021年发表的澳大利亚单中心纳入170例接受了CD19-CAR-T治疗的难治/复发DLBCL患者的回顾性分析中未发现TP53基因突变对CD19-CAR-T治疗疗效的影响,这是全球首篇专门研究TP53基因状态与CAR-T疗效关系的临床研究,作者认为CAR-T治疗有可能在一定程度上可以改善难治/复发TP53基因突变DLBCL患者的预后[14]。但在另一个方面,基础研究已证实p53突变干扰了激活先天免疫反应中细胞质DNA介导的cGAS-STING-TBK1-IRF3的信号传递、具有阻断先天免疫信号通路的活性,从而影响天然免疫信号并促进肿瘤的免疫逃逸[15];可以借鉴的,在CD19-CAR-T治疗急性淋巴细胞白血病的研究数据中,TP53基因状态虽然没有影响患者30天内疾病CR率,但存在TP53基因突变的患者6个月的OS和PFS显著低于TP53野生型患者[16]。因此,很多学者认为CD19-CAR-T对难治/复发TP53基因突变DLBCL患者的影响目前尚不能肯定、但很可能也不乐观。同样,同为免疫治疗,CD20/CD3双抗是否对TP53基因突变DLBCL患者的预后存在影响目前也不明确。作为一种新兴治疗方案,免疫治疗对这部分患者预后的影响值得进一步研究。
在国内,最新的医学研究进展也为我们提供了治疗TP53突变DLBCL的新策略。2023年10月6日,上海交通大学医学院附属瑞金医院赵维莅教授和王黎教授共同通讯在Signal Transduction and Targeted Therapy发表一项关于“人内源性逆转录病毒(HERV)作为TP53突变的弥漫性大B细胞淋巴瘤的表观遗传治疗靶点”的研究,该研究评估了667例新诊断DLBCL患者的TP53突变,其中576例接受R-CHOP治疗,91例接受地西他滨加R-CHOP治疗(DR-CHOP)。研究表明,地西他滨通过SUV39H1-H3K9me3-ERVs轴触发ERV表达,从而激活干扰素通路,对TP53突变的DLBCL患者进行增敏化疗并与R-CHOP协同,表明地西他滨通过调节组蛋白甲基化而具有新的抗肿瘤机制,这些发现进一步为ERVs作为重编程TME治疗TP53突变驱动型癌症的潜在表观遗传治疗靶点提供了初步临床依据[17]。厦门大学附属第一医院徐兵教授也于2023年11月22日开展一项“阿扎胞苷联合R-CHOP(AR-CHOP)治疗TP53突变且未经治疗的弥漫性大B细胞淋巴瘤的单臂临床研究(NCT06158399)”,该Ⅱ期研究目前正处于入组阶段,预计2025年5月达到主要研究终点[18]。
临床上存在着的一个显著的问题是,TP53突变型血液肿瘤对通过DNA损伤来诱导癌细胞死亡的细胞毒性药物展现出更强的耐药性,同时,这类肿瘤在代谢、基因组稳定性和自噬等方面也存在着缺陷,这些因素共同降低了它们对多种抗癌药物的敏感性。ADC药物由于提高了治疗窗口(如Pola携带的MMAE抗微管作用是长春新碱的1000倍),其临床使用是否有可能对TP53基因突变患者的预后产生影响?2022年1月,POLARIX研究结果在The New England Journal of Medicine公布:在既往未经治疗的DLBCL患者中,与R-CHOP相比,Pola-R-CHP治疗显示出显著PFS获益[19],但临床试验并未预设TP53基因突变亚组,因此,其对TP53基因突变患者的预后影响尚待后续分析。
5
伴TP53突变淋巴瘤的一种有希望的临床治疗新思路及未来展望
在过去十年中,由于分子谱分析和新治疗方法的进步,血液肿瘤的整体生存率有了显著提升。然而,TP53缺陷性淋巴瘤和白血病依然构成了一个严峻的临床难题。TP53突变在急性髓性白血病(AMLs)和非霍奇金淋巴瘤(NHLs)中发生率高达25%,在自然杀伤/T细胞淋巴瘤(NK/T)中更是高达60%。鉴于这些严峻的数据,当前迫切需要研发出针对TP53突变血液肿瘤的有效治疗方法,以改善患者的预后和生活质量[20]。
早在2013年9月,Blood上就有临床研究利用烟酰胺(Sirtuin抑制剂)和脱乙酰酶(DAC)抑制剂(伏立诺他)协同联合治疗复发/难治性DLBCL细胞株的体外实验,研究发现Sirtuin和DAC抑制剂联合治疗DLBCL可导致协同细胞毒性和BCL6和p53的乙酰化。伏立诺他联合烟酰胺治疗的复发性淋巴瘤患者的总有效率为24%,另有57%达到疾病稳定,表明该治疗方案在临床上具有一定的活性[21]。
由于TP53基因在生理病理过程中的重要作用及其突变后致病机制的复杂性,p53研究领域还有很多未解之谜。这是目前为止研究者已经开发的用来增强或恢复野生型p53功能的一些思路和前期方法、部分研究成果。
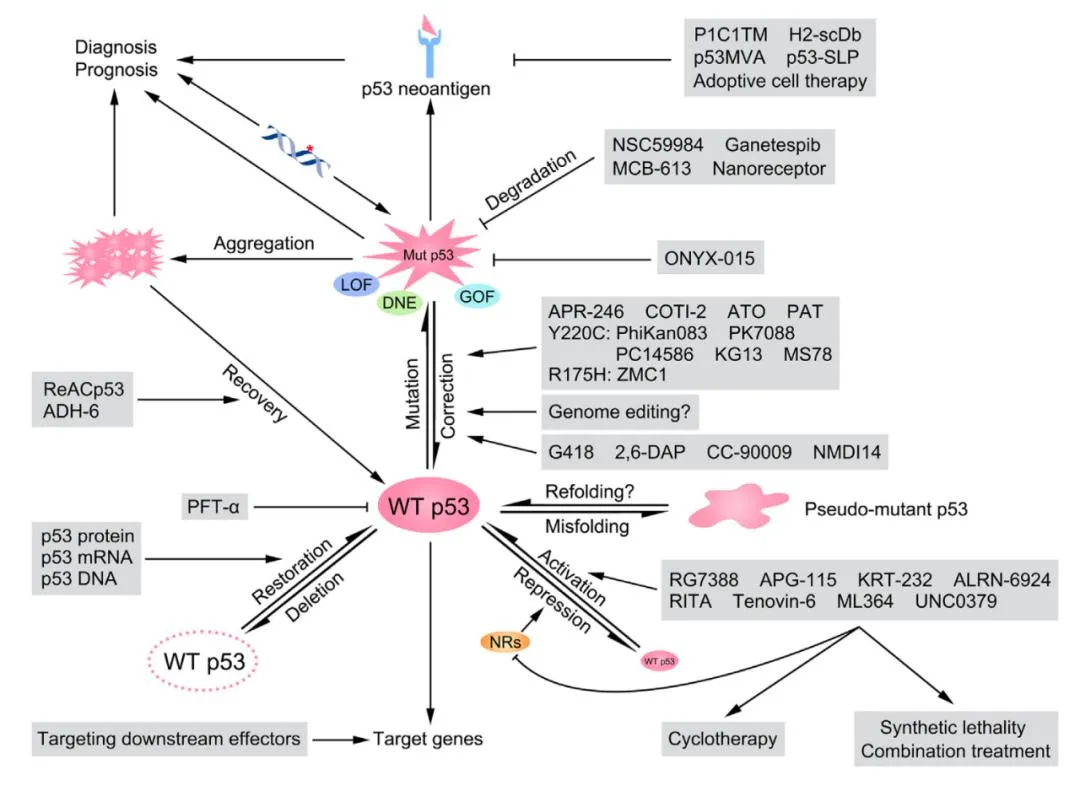
图8 靶向p53[2]
不久前,来自澳大利亚的研究团队在Caner Cell上发表了一篇文章,文章指出,通过BH3模拟物诱导的MOMP可以激活p53,进而促进血液肿瘤细胞的凋亡。同时,STING通路的激活则能触发血液肿瘤中p53非依赖性的细胞凋亡。更值得一提的是,当STING激动剂与BH3模拟物联合使用时,它们能够协同作用,有效杀死TP53突变的血液肿瘤细胞[20]。这一发现为我们提供了一条新的治疗思路:通过联合使用BH3模拟物和STING激动剂,可以促进TP53/TRP53野生型和TP53/TRP53突变型白血病和淋巴瘤的细胞凋亡。
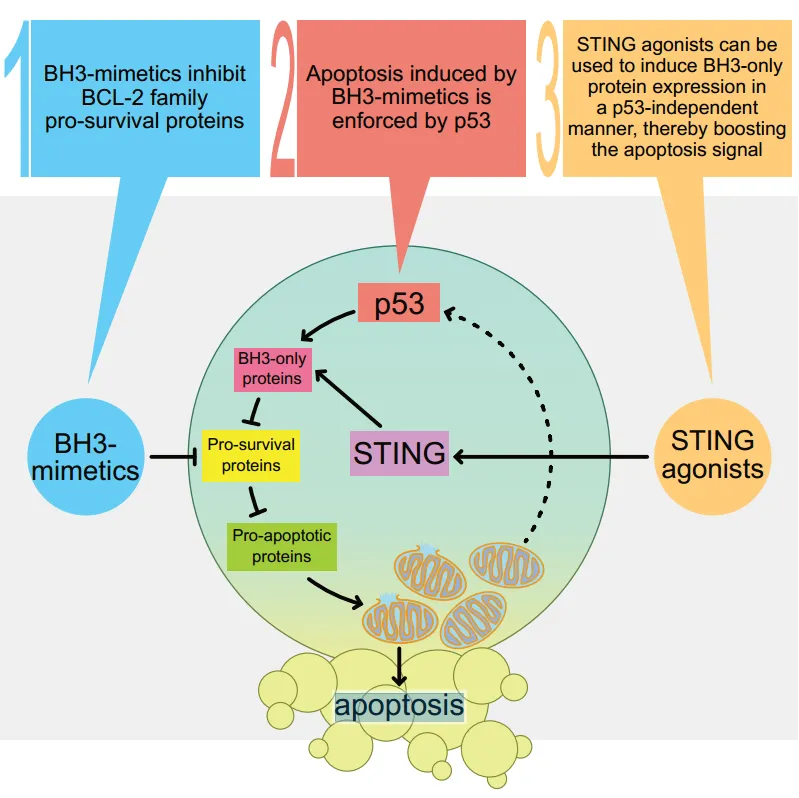
图9 联合使用BH3模拟物和STING激动剂治疗TP53突变型血液肿瘤[20]
TP53相关的基础研究和临床研究目前仍任重道远。

参考文献(向上滑动阅览)
[1]Lu TX, Young KH, Xu W, Li JY. TP53 dysfunction in diffuse large B-cell lymphoma[J]. Crit Rev Oncol Hematol, 2016, 97: 47-55.
[2]Liu Y, Su Z, Tavana O, Gu W. Understanding the complexity of p53 in a new era of tumor suppression[J]. Cancer Cell. 2024, 42(6): 946-967.
[3]Levine AJ. p53: 800 million years of evolution and 40 years of discovery[J]. Nat Rev Cancer, 2020, 20(8): 471-480.
[4]Du W, Xu A, Huang Y, et al. The role of autophagy in targeted therapy for acute myeloid leukemia[J]. Autophagy, 2021, 17(10): 2665-2679.
[5]Kastenhuber ER, Lowe SW. Putting p53 in Context[J]. Cell, 2017, 170(6): 1062-1078.
[6]Liu Q, Wang JH, Li XY, et al. The connection between LINE-1 retrotransposition and human tumorigenesis[J]. Hereditas. 2016, 38(2): 93-102.
[7]Hassin O, Oren M. Drugging p53 in cancer: one protein, many targets[J]. Nat Rev Drug Discov, 2023, 22(2): 127-144.
[8]王书楠, 白鸥. 弥漫大B细胞淋巴瘤临床预后系统与分子预后因素的研究进展[J].中华血液学杂志, 2016, 37(6): 538-541.
[9]Lacy SE, Barrans SL, Beer PA, et al. Targeted sequencing in DLBCL, molecular subtypes, and outcomes: a haematological malignancy research network report[J]. Blood, 2020, 135(20): 1759-1771.
[10]Voropaeva EN, Voevoda MI, Pospelova TI, et al. Prognostic impact of the TP53 rs1625895 polymorphism in DLBCL patients[J]. Br J Haematol, 2015, 169(1): 32-5.
[11]Dodero A, Guidetti A, Marino F, et al. Dose-adjusted EPOCH and rituximab for the treatment of double expressor and double-hit diffuse large B-cell lymphoma: impact of TP53 mutations on clinical outcome[J]. Haematologica, 2022, 107(5): 1153-1162.
[12]Chiappella A, Diop F, Agostinelli C, et al. Prognostic impact of TP53 mutation in newly diagnosed diffuse large B-cell lymphoma patients treated in the FIL-DLCL04 trial[J]. Br J Haematol, 2022, 196(5): 1184-1193.
[13]Yi Xiao, Jiaying Wu, Mi Zhou, et al. Orelabrutinib Plus R-CHOP Regimen in Treatment-Naïve Patients with TP53-Mutated Diffuse Large B-Cell Lymphoma (DLBCL)[J]. Blood, 2023, 142(Supplement 1): 6289.
[14]Porpaczy E, Wohlfarth P, Königsbrügge O, et al. Influence of TP53 Mutation on Survival of Diffuse Large B-Cell Lymphoma in the CAR T-Cell Era. Cancers (Basel)[J]. 2021, 13(22): 5592.
[15]Ghosh M, Saha S, Bettke J, et al. Mutant p53 suppresses innate immune signaling to promote tumorigenesis[J]. Cancer Cell, 2021, 39(4): 494-508.e5.
[16]Shah NN, Lee DW, Yates B, et al. Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL[J]. J Clin Oncol, 2021, 39(15): 1650-1659.
[17]Fang Y, Wang L, Zhao WL, et al. Human endogenous retroviruses as epigenetic therapeutic targets in TP53-mutated diffuse large B-cell lymphoma[J]. Signal Transduct Target Ther, 2023, 8(1): 381.
[18]National Library of Medicine. AZA Combined With RCHOP in P53-mutated DLBCL(NCT06158399)[EB/OL].(2023-12-11).https://www.clinicaltrials.gov/.
[19]Tilly H, Morschhauser F, Sehn LH, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma[J]. N Engl J Med, 2022, 386(4): 351-363.
[20]Diepstraten ST, Yuan Y, La Marca JE, et al. Putting the STING back into BH3-mimetic drugs for TP53-mutant blood cancers[J]. Cancer Cell, 2024, 23: S1535-6108(24)00128-4.
[21]Amengual JE, Clark-Garvey S, Kalac M, et al. Sirtuin and pan-class Ⅰ/Ⅱ deacetylase (DAC) inhibition is synergistic in preclinical models and clinical studies of lymphoma[J]. Blood, 2013, 122(12): 2104-13.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国