出品:科普中国
作者:秦亚龙(江苏省中国科学院植物研究所·南京中山植物园)
监制:中国科普博览
编者按:为解码生命科学最新奥秘,科普中国前沿科技项目推出“生命新知”系列文章,从独特的视角,解读生命现象,揭示生物奥秘。让我们深入生命世界,探索无限可能。
在自然界中,蚂蚁和植物之间相互影响、相互依存,经过漫长的演化,逐渐形成了一个个神奇的互利共生关系。本文通过蚂蚁和植物的共生关系,科学阐述蚂蚁和植物是如何协同进化的。
蚂蚁和植物的协同进化,始于蚂蚁以植物为食,之后,植物才进化出对蚂蚁有利的结构和习性。
蚂蚁与被子植物的协同进化
地球上有1.4万多种蚂蚁,是数量最多的昆虫之一,它们和被子植物大约都起源于1.4亿年前的白垩纪时期,现已分布在除南极洲以外的各个大陆。
2023年,《Evolution Letters》上的研究揭示了蚂蚁与被子植物(有花植物)在进化和扩散上的密切相关。研究指出,在6000多万年前的白垩纪晚期至古近纪早期,随着被子植物的叶片进化出更多气孔,它们所赖以生存的森林环境逐渐变得湿润,树木上的附生植物也越来越丰富。此时,原本在森林地下筑巢的蚂蚁也逐渐进化,分生出在树上筑巢的树栖蚂蚁,通过群落的垂直分层减少种间竞争。

植物与蚂蚁插画
(图片来源:veer图库)
当被子植物扩散到森林以外时,蚂蚁也随着被子植物扩散。过程中,被子植物进化出了多种食物供给方式,如油质体(种子上附属结构,含糖分、蛋白和脂质等)和花外蜜腺(生长在植物幼茎、叶、花梗等营养器官上的蜜腺)等,它们可能是被子植物影响蚂蚁进化的重要因素。
蚂蚁与植物蜜腺的协同进化
有些植物以蜜露为奖励,与蚂蚁形成了共生关系。我们这里所说的蜜露,与促进授粉的花蜜不同,通常是指花外蜜腺分泌的蜜露,可以吸引蚂蚁,抵御食草动物的啃食。据文献记载,近4000种开花植物中广泛存在花外蜜腺。
蕨类植物中,有些种类会有多样化的花外蜜腺。这些蜜腺分泌的花蜜组成可能与被子植物相似,含有单糖、多糖、氨基酸等。

蕨类植物多样的蜜腺
(图片来源:参考文献10)
最新研究指出,植物与食草动物的相互作用影响着进化轨迹。一些植物进化出了间接的防御策略,它们通过蜜露贿赂蚂蚁,接收蜜露的蚂蚁就充当了植物的保镖。
这些吸引蚂蚁的蜜腺在白垩纪同时起源于蕨类植物和被子植物,与蚁栖植物的兴起相吻合,且在蕨类植物和被子植物中均协同进化。当蕨类植物从森林地面过渡到树冠层时,它们会再次从现有的蚂蚁-被子植物系统中招募蚂蚁当保镖。
蕨类植物中,与蚂蚁共生的有水龙骨科Polypodiaceae鹿角蕨属Platycerium、蚁蕨属Lecanopteris和小蛇蕨属Microgramma等植物。
蚂蚁与鹿角蕨属共生
近年来,鹿角蕨属植物因其极高的观赏价值,受到越来愈多植物爱好者的追捧。该属植物的主要特征是叶两型,分为营养叶(不育叶、腐殖叶)和繁殖叶(可育叶、孢子叶)。营养叶基部呈覆瓦状,常附着在树干或枝干上,有些营业叶向上呈鸟巢状,可以接收腐殖质和雨露;而繁殖叶成熟时其背面可长出孢子进行繁殖,因多呈鹿角状而得名“鹿角蕨”。

鹿角蕨
(图片来源:作者拍摄)

二歧鹿角蕨营养叶
(图片来源:作者拍摄)
附生在树上和枝条上的鹿角蕨属植物,有时也会选择与蚂蚁一起共生,如马来鹿角蕨Platycerium ridleyi Christ,蚂蚁可在它的营养叶内筑巢,营养叶隆起的叶脉就像是蚂蚁行进的道路,有时叶片表面还会出现孔洞,可能也是蚂蚁为了方便进出打的通道。
作为回报,蚂蚁可以充当保镖,帮助马来鹿角蕨减少病虫害的发生,还可以把取食和繁育过程中所产生的腐殖质作为马来鹿角蕨的养料。
蚂蚁与蚁蕨属共生
蚁蕨属植物有着中空而膨大的根状茎,不同种的根状茎形态各不相同。它们的根状茎多有分枝,分枝顶端的凸起称为“叶足”,叶片从上面长出。
在共生系统中,虹琉璃蚁属Iridomyrmex和举腹蚁属Crematogaster的蚂蚁会在蚁蕨属植物膨大的根状茎里安家,此时,蚁蕨属植物不再以食物为诱惑,而是给蚂蚁们提供安全的“家”,蚂蚁则可通过粪便或食物残渣为蕨类提供养分,还可作为保镖帮助蚁蕨属植物抵御虫害,两者实现了双赢。

蚁蕨根状茎
(图片来源:PlantSystematics.org)
蚂蚁与小蛇蕨属共生
小蛇蕨属植物与蚂蚁的共生关系更有意思,它们不直接给蚂蚁提供住所,蚂蚁能入住的只能是其它昆虫留下的旧房子。
科研人员通过研究小鳞翅目昆虫诱导水龙骨科Polypodiaceae小蛇蕨属Microgramma多小鳞小蛇蕨Microgramma squamulosa (Kaulf.) de la Sota茎瘿内的蚂蚁区系演替,发现寄生在多小鳞小蛇蕨茎瘿内的昆虫发育成熟后会自行离开,并在虫瘿表面留下的孔洞。
这些虫瘿会被其它昆虫再次用作庇护所和筑巢地,而树栖蚂蚁就是最主要昆虫种类,实验收集的49个虫瘿中,共发现6种蚂蚁顺利住上了虫瘿二手房。

多小鳞小蛇蕨茎瘿寄生
左上:茎瘿;右上:小鳞翅目瘿虫蜕出瘿;
左下:蚂蚁生活茎瘿剖面图。右下:茎瘿上留下的孔。
(图片来源:参考文献9)
因此,生活在这些蕨类植物上的蚂蚁,在它们取食蜜露或抵御虫害过程中,如果碰到成熟的孢子,就可以帮助这些蕨类植物完成孢子的传播。
蚂蚁与细菌共生
蚂蚁在与植物互利共生和协同进化过程中,蚁巢中多样性的伴生细菌也在帮助蚁群抵御生病和缺氮等不利条件,对蚁群的发展至关重要。所以,蚂蚁与细菌共生也被认为是蚂蚁可以在热带雨林树冠上定居的必要条件。
蚂蚁与植物授粉的协同进化
截至目前,蚂蚁参与授粉的植物被发现的还很少,蚂蚁授粉的作用也可能被低估。多数人认为,蚂蚁在多数情况下不能飞行、不能携带大量花粉,自身分泌物会降低花粉活力等,这些都是蚂蚁授粉植物稀少的影响因素。
然而,我们却忽视蚂蚁家族的庞大,忽视了蚂蚁与植物长期的共生关系,有些植物可能会为了适应蚂蚁而进化,只是我们现在研究的还不够深入。当我们查寻蚂蚁授粉资料时,出现最多的就是兰科植物了,似乎兰科植物更适合蚂蚁授粉,我们通过几个经典的蚂蚁—兰花授粉案例来进行阐述。
在澳大利亚南部,生长着一种小兔兰Leporella fimbriata (Lindl.) A.S.George,它们开花时,花朵的唇瓣会模拟成当地一种雌性蚂蚁的样子,从而吸引有翅膀的婚飞雄性蚂蚁飞来与之交配。在雄蚁假交配过程中,就帮助小兔兰完成了授粉。
为了能实现授粉,小兔兰和雄蚁的地理分布、小兔兰的开花期与雄蚁的婚飞期进化为一致,小兔兰在花期会释放出特定的信息素,还进化出独特的花型来吸引有翅雄蚁,两者的协同进化造就了如此经典的蚂蚁授粉方式。

小兔兰
(图片来源:Seeds of South Australia)
同样在澳洲分布的另一种兰花——小花葱叶兰Microtis parviflora R.Br.,它们的有效传粉者却是当地一种没有翅膀的工蚁,而且还有可能是唯一的传粉者。
在授粉过程中,或许是因为蚂蚁自身分泌的抗生素会大大降低花粉的存活率。因此,这些蚂蚁携带该兰花花粉时,身体与花粉之间会通过一根短柄相连,这样就避免了蚂蚁分泌抗生素的胸腺与花粉直接接触,从而保证了授粉的成功。
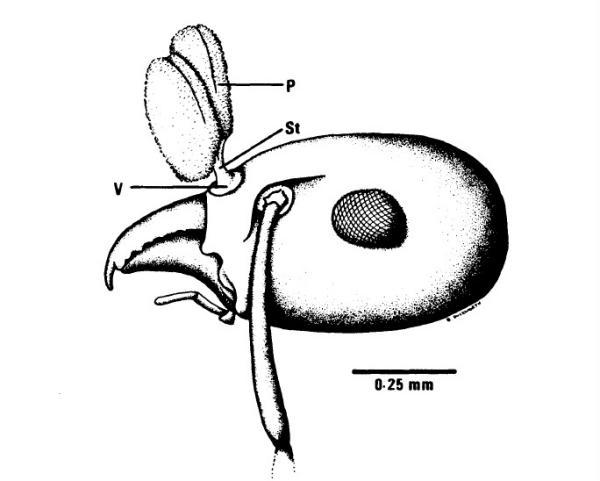
小花葱叶兰的蚂蚁授粉方式
P:花粉;St:短柄;V:粘盘
(图片来源:参考文献8)
我国研究人员发现,蚂蚁还是高山鸟巢兰Neottia listeroides Lindl.和花叶对叶兰Neottia puberula var. maculata (Tang & F.T.Wang) S.C.Chen, S.W.Gale & P.J.Cribb的最主要传粉者。
它们在花朵内取食花蜜过程中,头部运动会粘上花粉团,进而帮助花朵完成授粉。有趣的是,当蚂蚁粘上花粉团后,花朵的蕊喙(兰科植物蕊柱前面的舌状突起部分)会立即向下运动盖住柱头,数小时后再重新抬起,有效防止花粉授在自己的柱头上,避免了自花授粉。

高山鸟巢兰
(图源:RangerLantern 王翰臣)
虽然也是蚂蚁帮助授粉,生长在高黎贡山的心启兰Cleisocentron malipoense (Z.J.Liu & L.J.Chen) R.Rice则与高山鸟巢兰和花叶对叶兰不同。心启兰在树栖蚂蚁的帮助下,很少会发生异株异花授粉,主要以自花授粉或同株异花授粉为主。

心启兰
(图源:OrchidRoots)
蚂蚁自身的分泌物会降低花粉活力,这是不争的事实。蚂蚁在生命活动过程中,会通过身上的特殊腺体分泌抗生素,这些抗生素既可被用于治疗自身伤口,也可在种植真菌(蘑菇)时被用来抑制真菌或病原体等植物病害的发生,但却会破坏花粉颗粒从而导致授粉失败。

蚂蚁和蜜蜂共同为彩烟木属植物授粉
(图片来源:参考文献4)
然而,生活在澳大利亚的一种彩烟木属Conospermum植物经过长期的协同进化,它们的花粉可以有效地抵御蚂蚁抗生素的破坏,从而实现蚂蚁和本地蜜蜂一起参与授粉,与蚂蚁建立了互利共生的授粉关系,进一步保证了授粉率。

观察蚂蚁的小女孩
(图片来源:veer图库)
总结
蚂蚁虽小,但它们作为自然界重要的生物类群,在生态系统中发挥着非常重要的作用。蚂蚁与植物以及其他生物的互作关系,还有许多未解之谜等着我们去发现和探索,让我们一起亲近自然,走进身边的一草一木一生灵,用发现的眼光看自然万物,探索自然的美与神奇。
参考文献:
1.刘仲健, 陈利君, 刘可为等. 心启兰属(Chenorchis)——兰科一新属及其蚂蚁传粉的生态策略[J].生态学报, 2008, 28(6):12.
2.王淳秋.蚂蚁参与的传粉系统——基于鸟巢兰属和对叶兰属三种兰科植物的传粉生物学研究[J].中国科学院植物研究所, 2008.
3.HONOR,GAY.Rhizome structure and evolution in the ant-associated epiphytic fern Lecanopteris Reinw. (Polypodiaceae)[J]. Botanical Journal of the Linnean Society, 1993, 113(2):135-160.
4.Kleber D C , Maura T S H .In search of unusual interactions. A commentary on: Pollen adaptation to ant pollination: a case study from the Proteaceae'[J].Annals of Botany, 2020(3):3.
5.Matthew P. Nelsen, Corrie S. Moreau, C. Kevin Boyce, et al. Macroecological diversification of ants is linked to angiosperm evolution[J]. Evolution Letters, 2023, 7(2), 79-87.
6.Nepel M , Mayer V E , Barrajon-Santos V W D .Bacterial diversity in arboreal ant nesting spaces is linked to colony developmental stage[J].Communications Biology, 2023, 6(1).
7.Peakall R .The unique pollination of Leporella fimbriata (Orchidaceae): Pollination by pseudocopulating male ants (Myrmecia urens, Formicidae)[J]. Plant Syst. Evol, 1989, 167:137-148.
8.Peakall R , Beattie A J . Pollination of the orchid Microtis parviflora R. Br. by flightliss worker ants[J]. Functional Ecology, 1989, 3(5):515-522.
9.Santos M G , Porto G F , Lancellotti I R ,et al. Ant fauna associated with Microgramma squamulosa (Kaulf.) de la Sota (Polypodiaceae) fern galls[J].Revista Brasileira de Entomologia, 2019, 63(2).
10.Suissa J S , Li F W , Moreau C S .Convergent evolution of fern nectaries facilitated independent recruitment of ant-bodyguards from flowering plants[J].Nature Communications, 2024, 15(1).






 2024-09-17
2024-09-17


 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国