导读
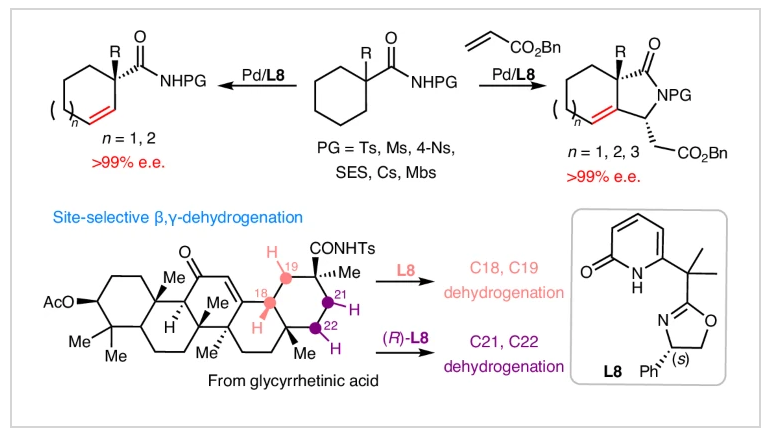
近日,美国斯克利普斯研究所(The Scripps Research Institute)余金权课题组报道了手性噁唑啉-吡啶酮配体对环烷基酰胺的β,γ-脱氢反应和β,γ-脱氢-烯基化反应。不同环尺寸(6 ~ 8元)的碳环均可利用此转化以优异的对映选择性(>99% ee)实现手性β,γ-不饱和酰胺或β-烷基烯-γ-内酰胺的合成。由于反电子需求,这些手性β,γ-不饱和六元碳环不能通过Diels-Alder反应获得,因为所需的缺电子二烯在与富电子双键在反应之前会发生二聚化。值得注意的是,使用单一对映体的配体可以精确控制复杂五环三萜天然产物脱氢的选择性,从而实现E环上四个位置的选择性修饰。相关成果发表在Nat. Synth.上,文章链接DOI:10.1038/s44160-024-00628-z。
(图片来源:Nat. Synth.)
正文
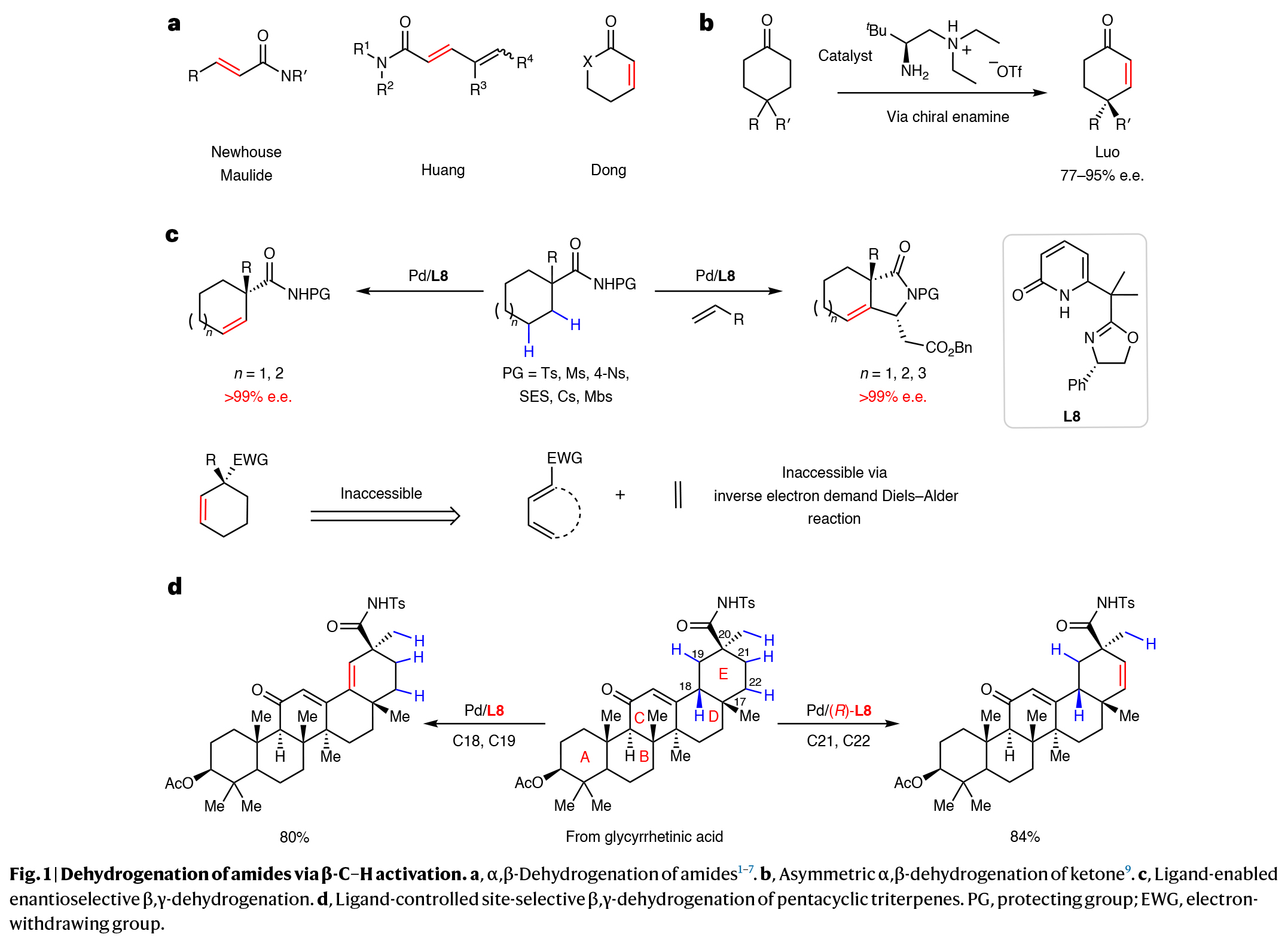
尽管羰基化合物(包括酰胺、酮、酯、醛和酸)的α,β-脱氢反应已经取得了实质性的进展(Fig. 1a),但β,γ-脱氢以及不对称脱氢等重大挑战仍有待解决。虽然有很少的例子通过手性烯胺对酮的不对称α,β-氧化已被报道(Fig. 1b),但最近报道的酰胺α,β-脱氢策略还尚未呈现不对称过程。最近,美国斯克利普斯研究所(The Scripps Research Institute)余金权课题组发展了钯/手性噁唑啉-吡啶酮催化,环烷基酰胺的对映选择性β,γ-脱氢反应,以高达99%的对映选择性实现了一系列不饱和碳环的合成(Fig. 1c)。值得注意的是,利用手性配体的每个对映体均可以精确控制复杂五环三萜天然产物脱氢选择性,从而实现E环上四个位置的修饰(Fig. 1d)。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
(图片来源:Nat. Synth.)
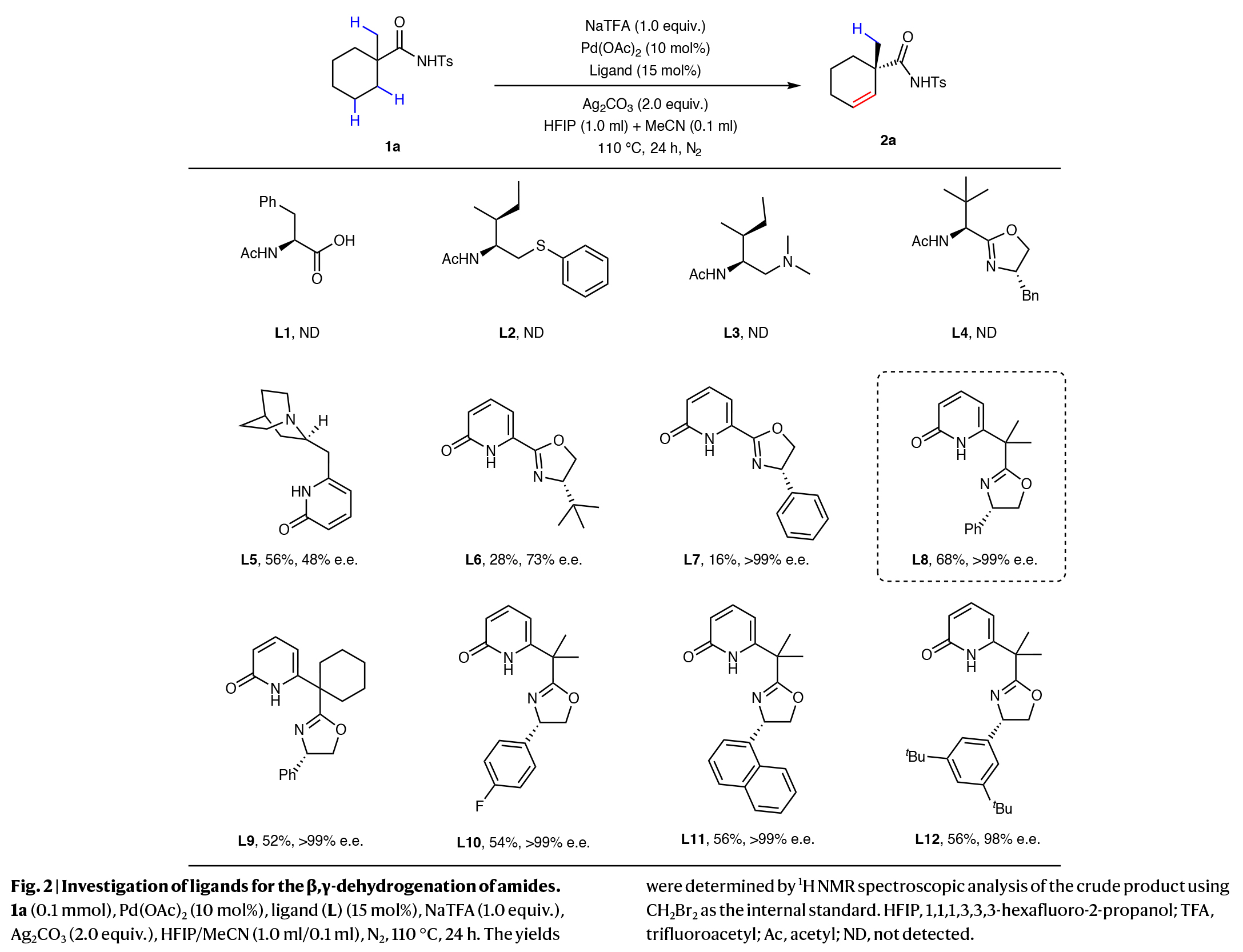
首先,作者选择Ts保护的脂肪酰胺1a作为模板底物对反应条件进行了探索(Fig. 2)。通过对一系列配体进行筛选,作者发现当使用1a (0.01 mmol), Pd(OAc)2 (10 mol%), L8 (15 mol%), NaTFA (1.0 equiv.), Ag2CO3 (2.0 equiv.), 在HFIP/MeCN (1.0 ml/0.1 ml)中,氮气氛围下110 °C反应24 h,可以以68%的产率,>99% ee得到目标脱氢产物2a。
(图片来源:Nat. Synth.)
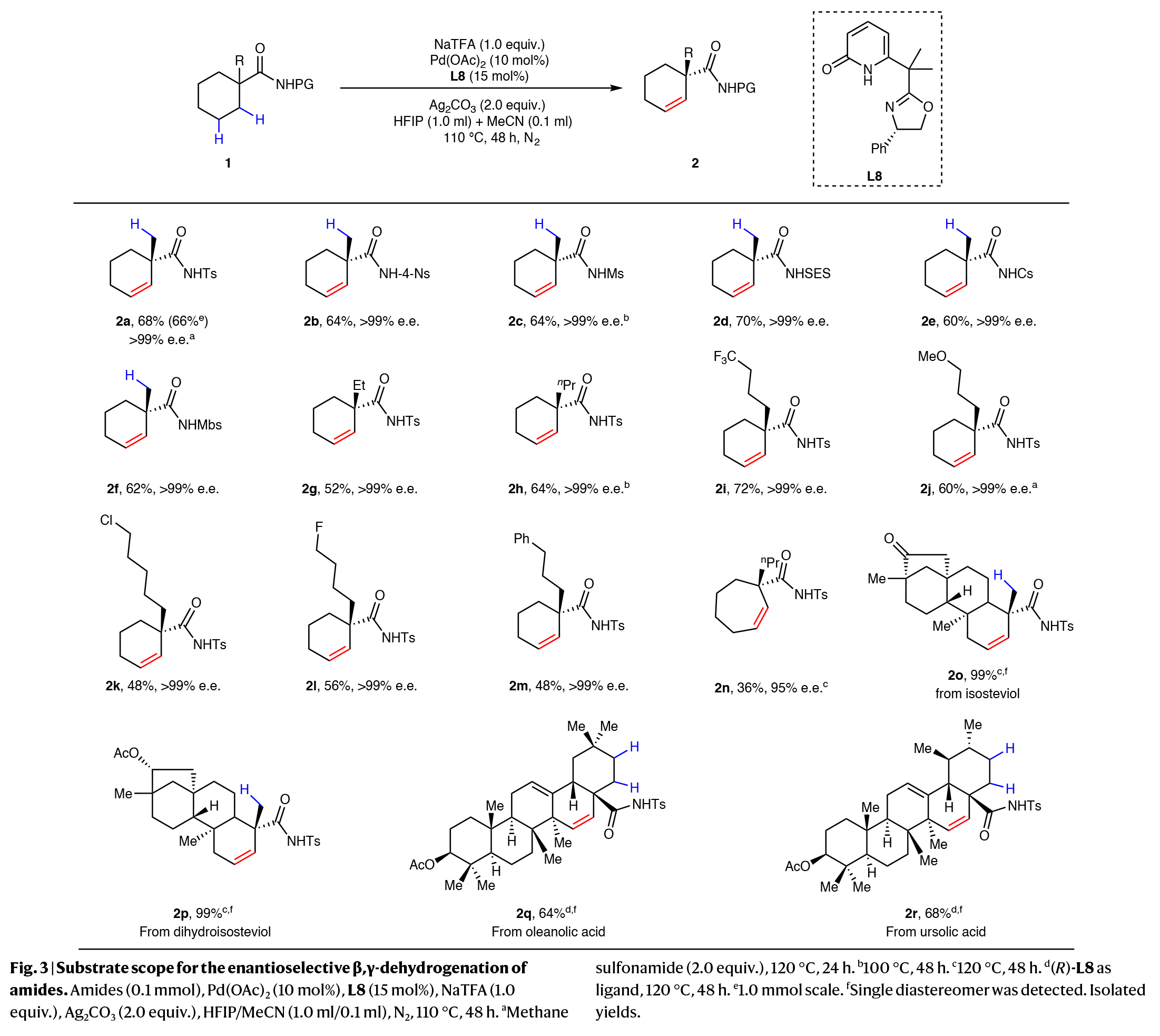
在得到了最优反应条件后,作者对脂肪族酰胺的底物范围进行了考察(Fig. 3)。实验结果表明,各种基于磺酰基的保护基团,包括Ts (2a)、4-硝基苯磺酰基(4-Ns) (2b)、甲酰基(Ms) (2c)、2-三甲基硅基乙基磺酰基(SES) (2d)、4-三甲基苯磺酰基(Cs) (2e)和4-甲氧基苯磺酰基(Mbs) (2f)均可兼容。具有不同α-取代基的环己基酰胺,如三氟甲基(2i)、甲氧基(2j)、氯(2k)和氟(2l)均具有良好的耐受性,且氯原子是进一步衍生化的有用基团。除环己基酰胺外,环庚基酰胺也能以36%的产率得到所需的β,γ-脱氢产物2n,ee为95%。此外,为了证明该方案的可扩展性,作者在1.0 mmol的规模下对1a进行β,γ-脱氢,以66%的收率获得不饱和酰胺2a,且ee超过99%。
(图片来源:Nat. Synth.)
接下来,作者考察了萜烯天然产物的后期脱氢反应(Fig. 4)。异甜菊醇(Isosteviol)和二氢异甜菊醇(dihydroisosteviol)是重要的二萜,以其多种药理活性而闻名,包括抗炎、降压、抗癌、抗病毒和抗菌等,它们均能参与转化以优异的产率得到相应的β,γ-脱氢产物(2o, 2p)。令人惊讶的是,虽然齐墩果酸(oleanolic acid)和熊果酸(ursolic acid)有两个相邻的环己基环均具有β,γ-脱氢位点,但实验结果表明只有一个环发生了去饱和,产率分别为64%和68% (2q, 2r)。此外,甘草次酸(glycyrrhetinic acid)、3-氧甘草次酸(3-oxoglycyrrhetinic acid)和卡贝诺酮酸(carbenoxolone acid)均具有良好的位点选择性。值得注意的是,使用手性噁唑啉-吡啶酮配体的两个对映体分别实现了E环的两个不同位点的脱氢,以72-88%的产率得到相应的产物2aa-2af。这两个位点选择性的不饱和产物为这类五环三萜的整个E环的编辑提供了机会。
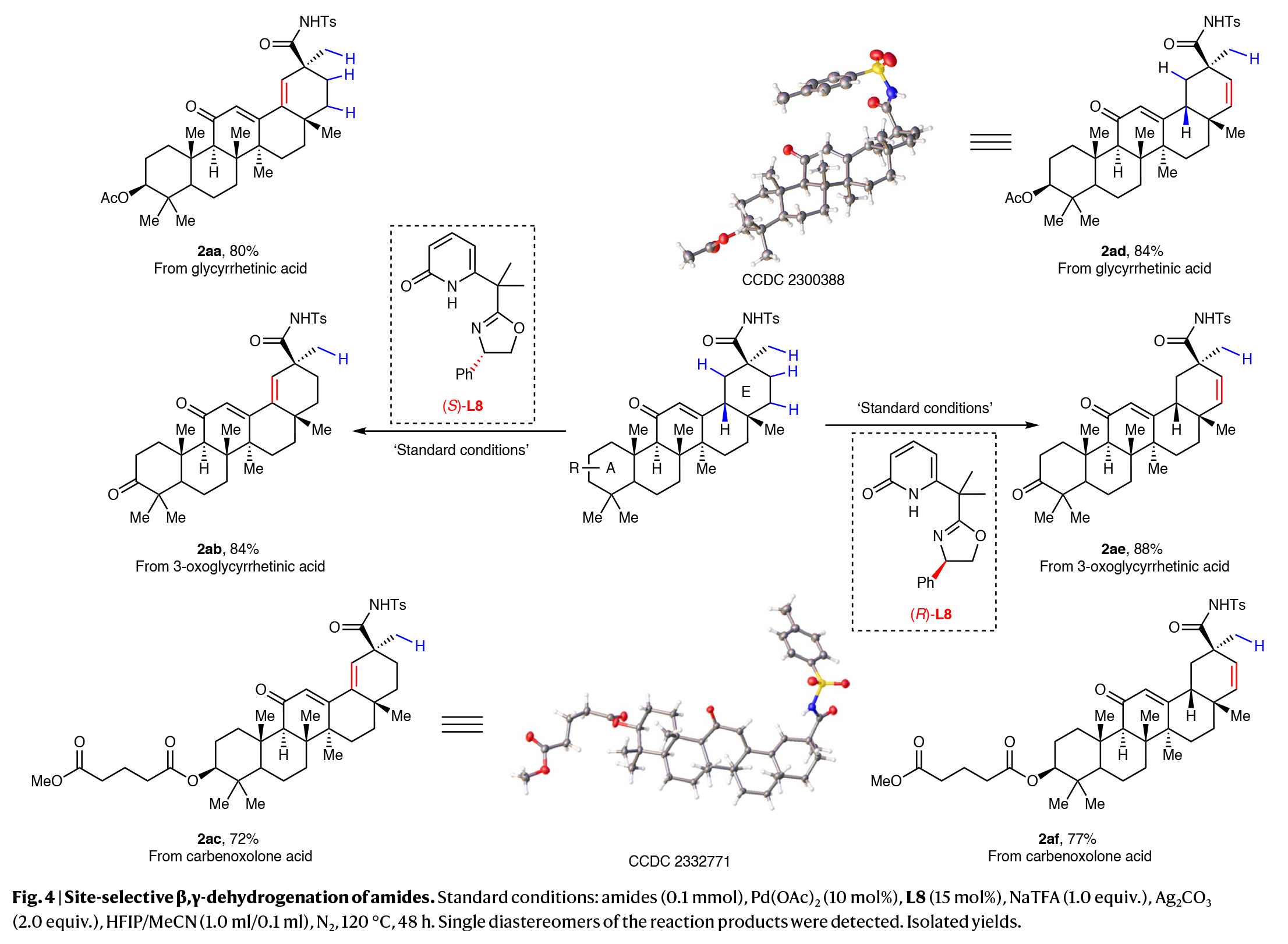
(图片来源:Nat. Synth.)
随后,受作者之前对串联脱氢和烯基化研究的启发,作者还探索了脂肪族酰胺是否可以兼容此串联反应,实现重要的手性γ-内酰胺产物的合成。高兴的是,使用噁唑啉-吡啶酮配体可以实现不对称脱氢和随后的烯基化过程,且最佳反应条件为:酰胺 (0.1 mmol), 烯烃(0.2 mmol), Pd(OAc)2 (10 mol%), L8 (15 mol%), NaOAc (2.0 equiv.), Ag2CO3 (2.0 equiv.), HFIP/MeCN (1.0 ml/0.1 ml), 90 °C, 48 h。在得到了最佳反应条件后,作者考察了该串联过程的底物范围(Fig. 5)。实验结果表明1-甲基环己基-1-酰胺连有的不同保护基团,包括Ts (3a), Ms (3b), SES (3c),Mbs (3d),Cs (3e)和4-Ns (3f)均可兼容,以高达72%的产率,超过99% ee得到相应的β-烷基烯-γ-内酰胺产物。此外,三氟甲基(3j)、氟(3k)、氯(3l)和甲氧基(3m)等多种α-取代基均可兼容,以42-64%的产率,>99% ee得到相应的产物。除环己基类酰胺外,该反应对不同环尺寸的底物,如环庚基(3n)和环辛基(30)也可兼容,以中等产率和优异的ee得到产物。值得注意的是,以1a为原料进行1.0 mmol规模的反应时,可以以66%的产率,> 99% ee得到产物3a。
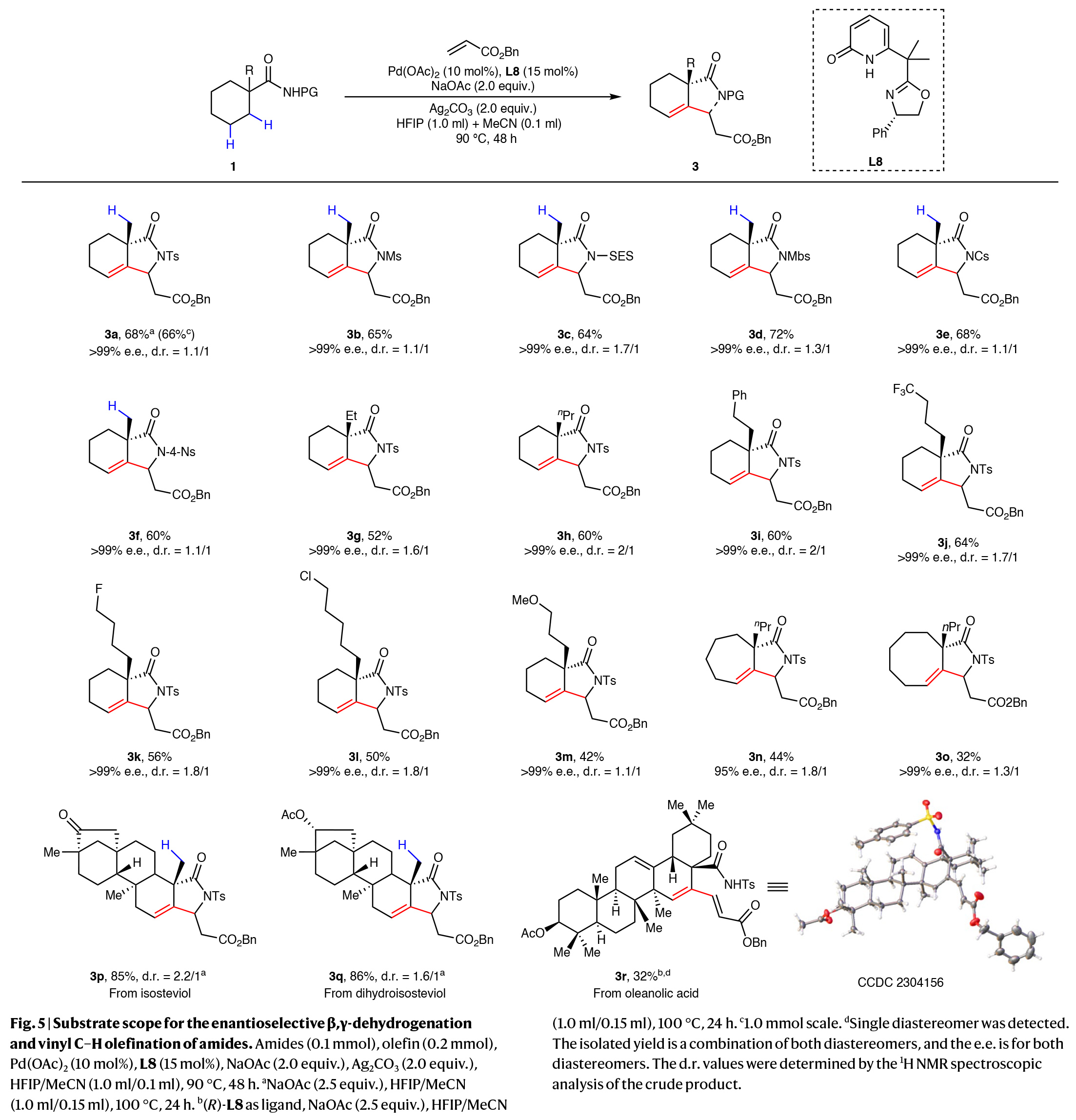
(图片来源:Nat. Synth.)
该串联反应与结构复杂的二萜如异甜菊醇(3p)和二氢异甜菊醇(3q)同样具有良好的兼容性,以良好的产率得到相应的β-烷基烯-γ-内酰胺产物。有趣的是,齐墩果酸(3r)只进行了烯基化,而没有进行进一步的γ-内酰胺化。此外,使用甘草次酸、3-氧甘草次酸和卡贝诺酮酸作为底物时,均以良好的位点选择性得到产物(Fig. 6)。特别值得注意的是,当作者使用手性噁唑啉-吡啶酮配体的两种对映体反应时,通过对四个不同位点(3aa-3af)的修饰,产生了明显不同的E环脱氢模式。
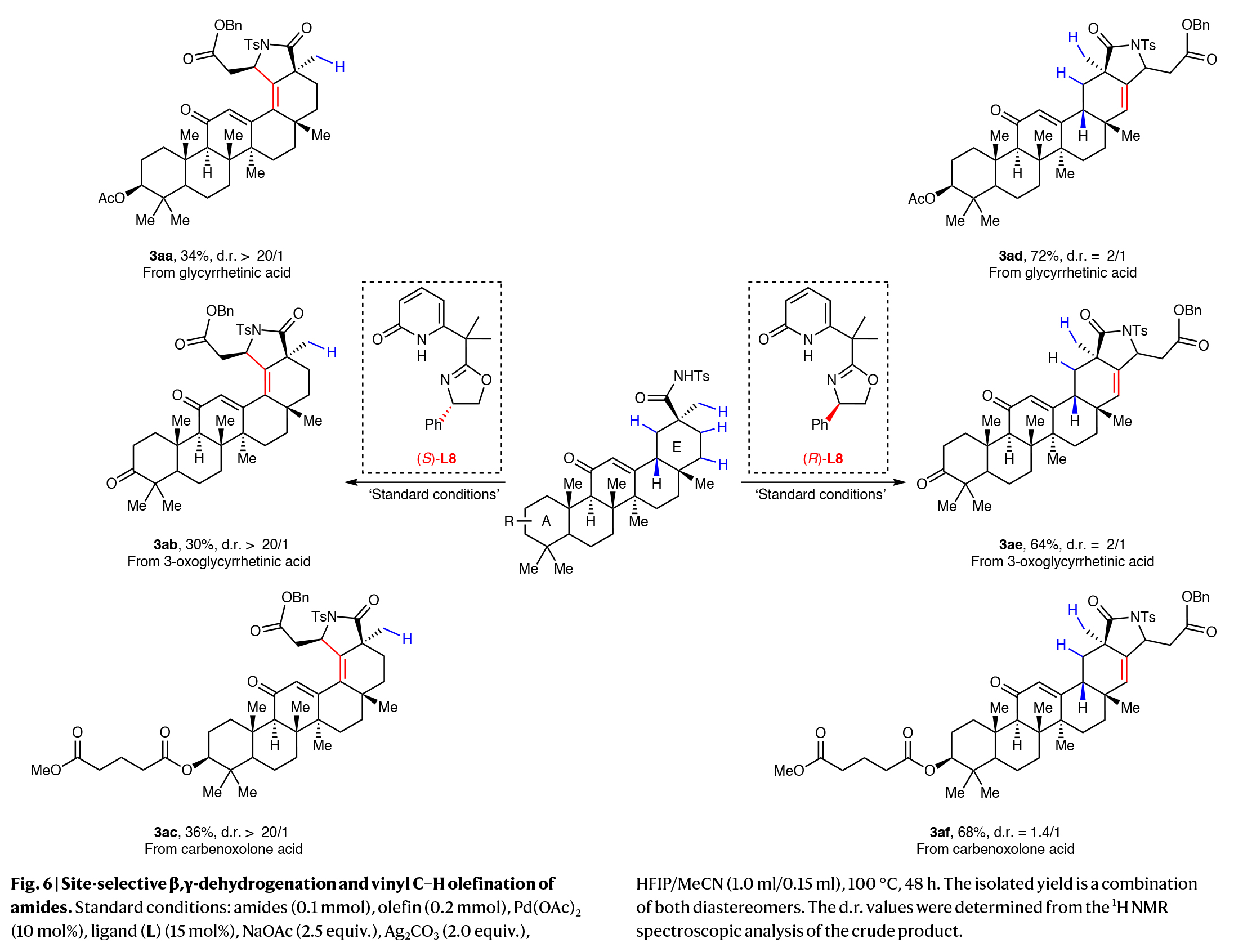
(图片来源:Nat. Synth.)
接下来,作者使用1a为模板酰胺底物考察了烯烃偶联配偶体的兼容范围(Fig. 7)。除了各种各样的丙烯酸酯衍生物(5a-5c)以外,其它Michael受体,包括五氟苯乙烯(5d),乙烯基膦酸二乙酯(5e),α-亚甲基丁内酯(5f),丙烯腈(5g),N-丙烯酰吗啉(5h)和乙烯基砜(5i, 5j)均可兼容,以中等至良好的收率(32-84%)得到所需的β-烷基-γ-内酰胺或β-烯基产物,且ee超过99%。其中富马酸二甲酯(5c),五氟苯乙烯(5d)和α-亚甲基丁内酯(5f)这两个在C-H烯基化反应中具有挑战性的偶联配偶体均可兼容。此外,N-苯基马来酰亚胺(5k)也是合适的偶联配偶体,以中等产率和良好的ee (>99%)得到手性螺环吡咯烷。值得注意的是,其他缺电子烯烃,包括乙烯基磺酰氟(5l)、苯基(乙烯磺酰)胺(5m)、2-(乙烯磺酰)苯并[d]噻唑(5n)和4-戊-3-酮(5o)不能兼容。
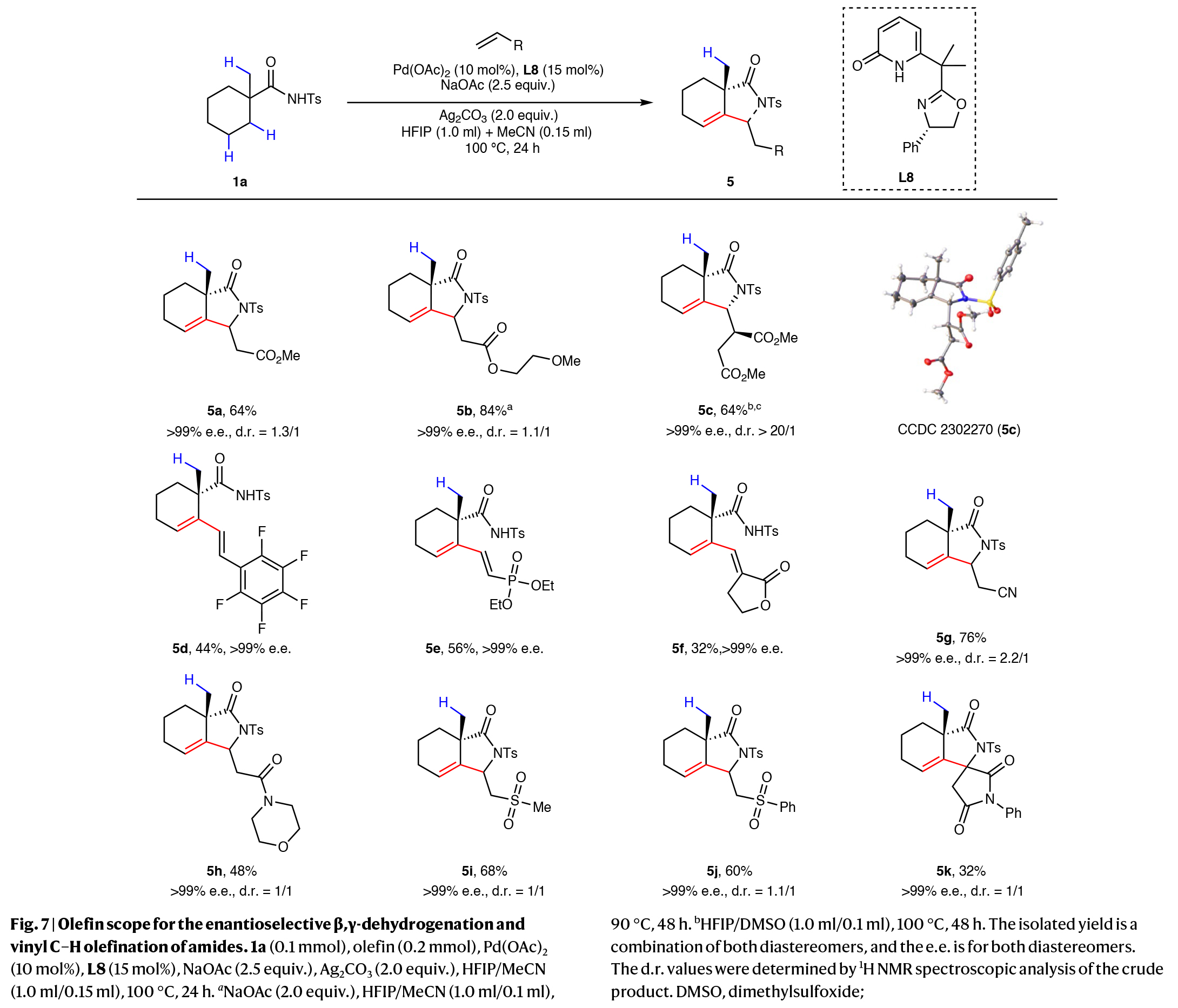
(图片来源:Nat. Synth.)
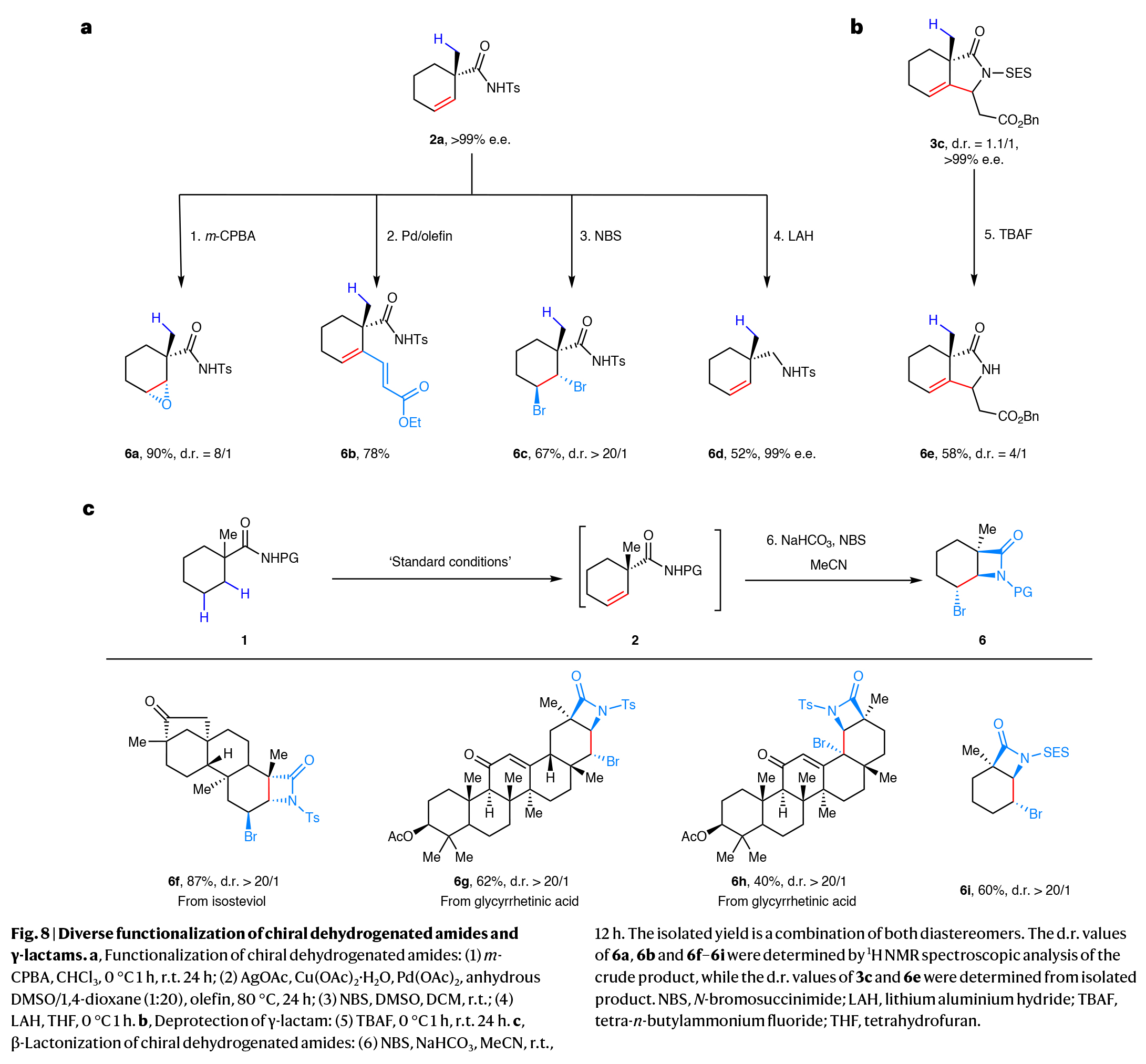
为了证明此转化的实用性,利用利用产物进行了后续衍生化(Fig. 8)。作者利用β,γ-去饱和酰胺形成了一系列结构多样的手性产物,在远端位置形成了碳-碳和碳-杂原子键,而这使用传统方法是具有挑战性的。2a与间氯过氧苯甲酸(m-CPBA)反应可以90%的产率得到相应的手性环氧化物(6a),非对映选择性良好(dr = 8/1)。此外,对2a进行了高度立体特异性的钯催化脱羧烯基化反应,可以在β,γ-不饱和酰胺的γ-位上引入额外的烯基(6b)。此外,通过烯基的二溴化可以得到手性反式二溴产物(6c),具有完全的非对映选择性。在LiAlH4存在下,酰胺2a还原得到手性不饱和环胺(6d),产率为52%。此外,作者还成功实现了酰胺导向基团的脱除,以58%的产率得到β-烷基烯-γ-内酰胺(6e)。
(图片来源:Nat. Synth.)
总结
余金权课题组利用手性噁唑啉-吡啶酮配体实现了酰胺的β,γ-脱氢和串联β,γ-脱氢-烯基化。该方法可以将环烷基酰胺直接转化为手性β,γ-不饱和酰胺或β-烷基烯-γ-内酰胺,具有优异的对映选择性(>99% ee)。所得的手性β,γ-不饱和酰胺产物为合成手性胺提供了多种途径,并可实现下游转化,如环氧化、二溴化和β-内酰胺化。值得注意的是,该催化体系与多种重要的天然产物(包括五环三萜)兼容,可以在不同位置进行选择性修饰。
文献详情:
Synthesis of chiral carbocycles via enantioselective β,γ-dehydrogenation
Tao Sheng, Tao Zhang, Zhe Zhuang, Jin-Quan Yu*.
Nat. Synth., 2024
https://doi.org/10.1038/s44160-024-00628-z.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国