导读
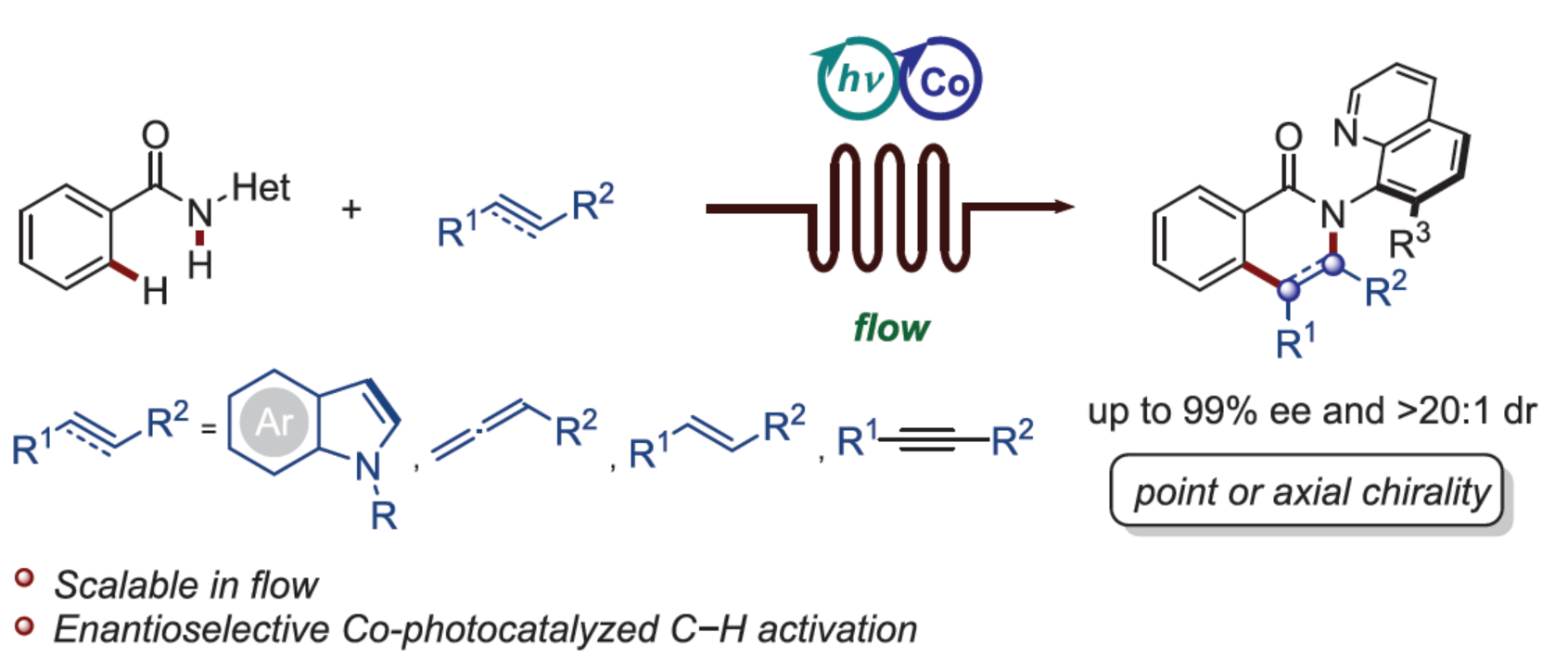
近日,德国哥廷根大学Lutz Ackermann课题组报道了一种将有机光氧化还原催化和对映选择性钴催化的C-H活化相结合的策略,使吲哚能够以对映选择性的方式进行区域和立体选择性双重官能团化反应,合成了一系列手性吲哚并[2,3-c]异喹啉-5-酮,对映选择性高达99%。通过连续流中的对映选择性C-H活化和环化,可直接获得中心和轴手性分子,从而证明了钴光氧化还原(cobaltaphotoredox)催化的稳健性。
(图片来源:J. Am. Chem. Soc.)
正文
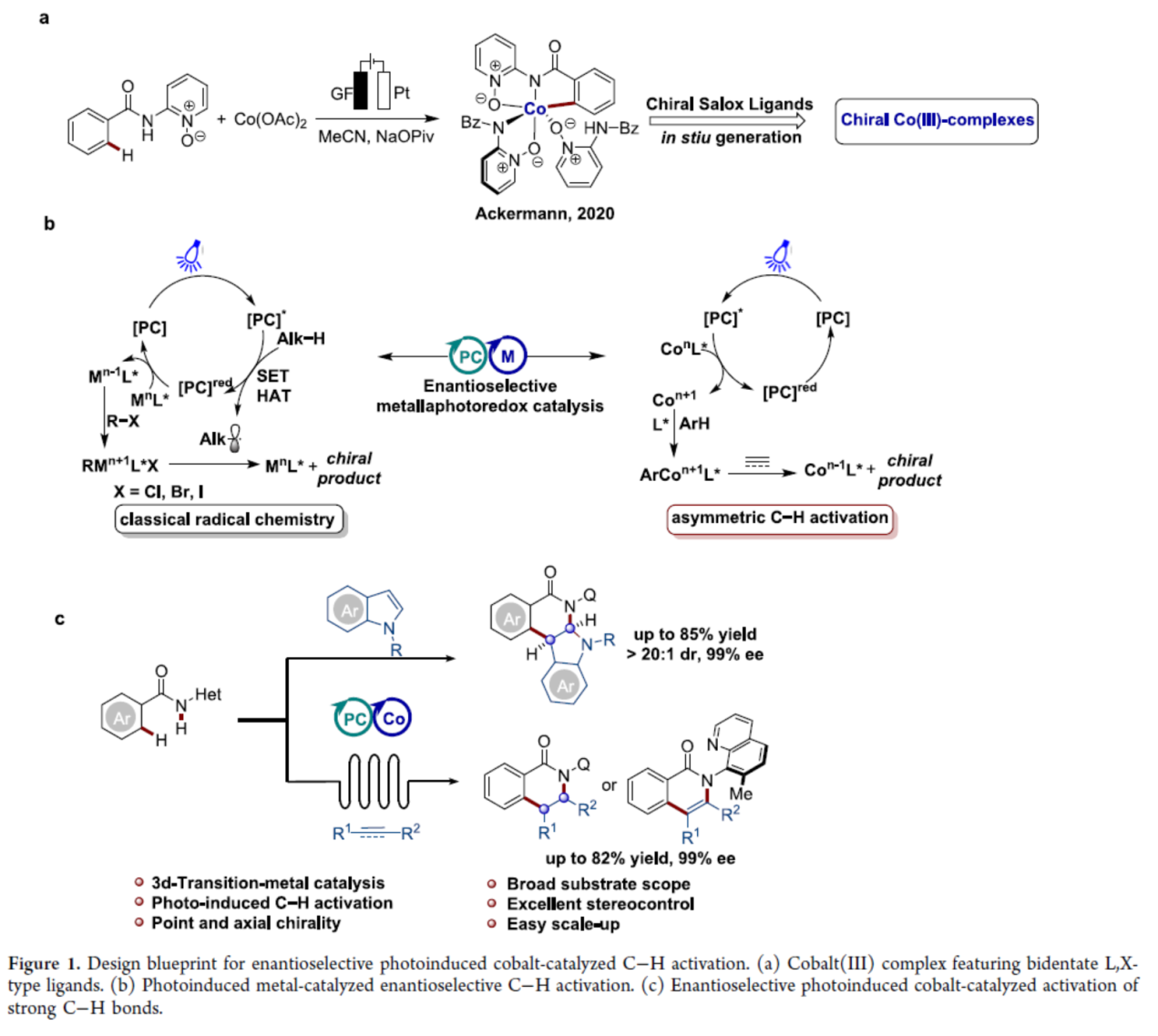
在过去的几十年里,光化学已成为合成复杂分子的环境友好的平台。光诱导催化与有机催化、酶催化和过渡金属催化等对映选择性催化相结合的策略,为手性分子的合成提供了一种高效的策略。与传统的对映选择性方法相比,光氧化还原催化的引入实现了温和与绿色的反应条件。近些年来,过渡金属催化的对映选择性C-H活化已成为构建C-C和C-Het键的有效方法。2017年,Ackermann课题组(Angew. Chem., Int. Ed. 2017, 56, 10378.)报道了一种在高价钴(III)催化下首次利用单保护氨基酸(MPAA)配体进行对映诱导(enantioinduction),但对映选择性较低。2018年,Ackermann课题组(Angew. Chem., Int. Ed. 2018, 57, 15425.)设计了一种C2-对称羧酸,首次促进了高度对映选择性高价钴催化的C-H活化。详细的机理研究,包括用两个苯甲酰胺底物作为配体分离关键的环金属化钴(III)配合物(Figure 1a),表明了手性LX-型配体在对映选择性控制的潜力。因此,通过用双齿手性配体(如MPAAs)代替苯甲酰胺底物之一,可以实现钴催化C-H活化中的对映选择性控制。最近,化学家们开发了一系列将对映选择性3d过渡金属催化与光氧化还原催化相结合的策略。这些方法通过单电子转移(SET)或氢原子转移(HAT)过程来实现C-H断裂,因此仅限于弱和活化的C-H键(Figure 1b,left)。相比之下,在可见光下实现强芳烃键的对映选择性活化还不发达,因为合适的配体可同时降低金属的氧化还原电位并控制完全对映选择性(Figure 1b,right),并且只有有毒和昂贵的钯才能实现。因此,利用地球丰富的3d金属进行对映选择性光诱导C-H活化是非常理想的。近日,德国哥廷根大学Lutz Ackermann课题组首次报道了一种对映选择性钴光氧化还原催化直接C-H活化反应,合成了一系列手性吲哚并[2,3-c]异喹啉-5-酮(Figure 1c)。
(图片来源:J. Am. Chem. Soc.)
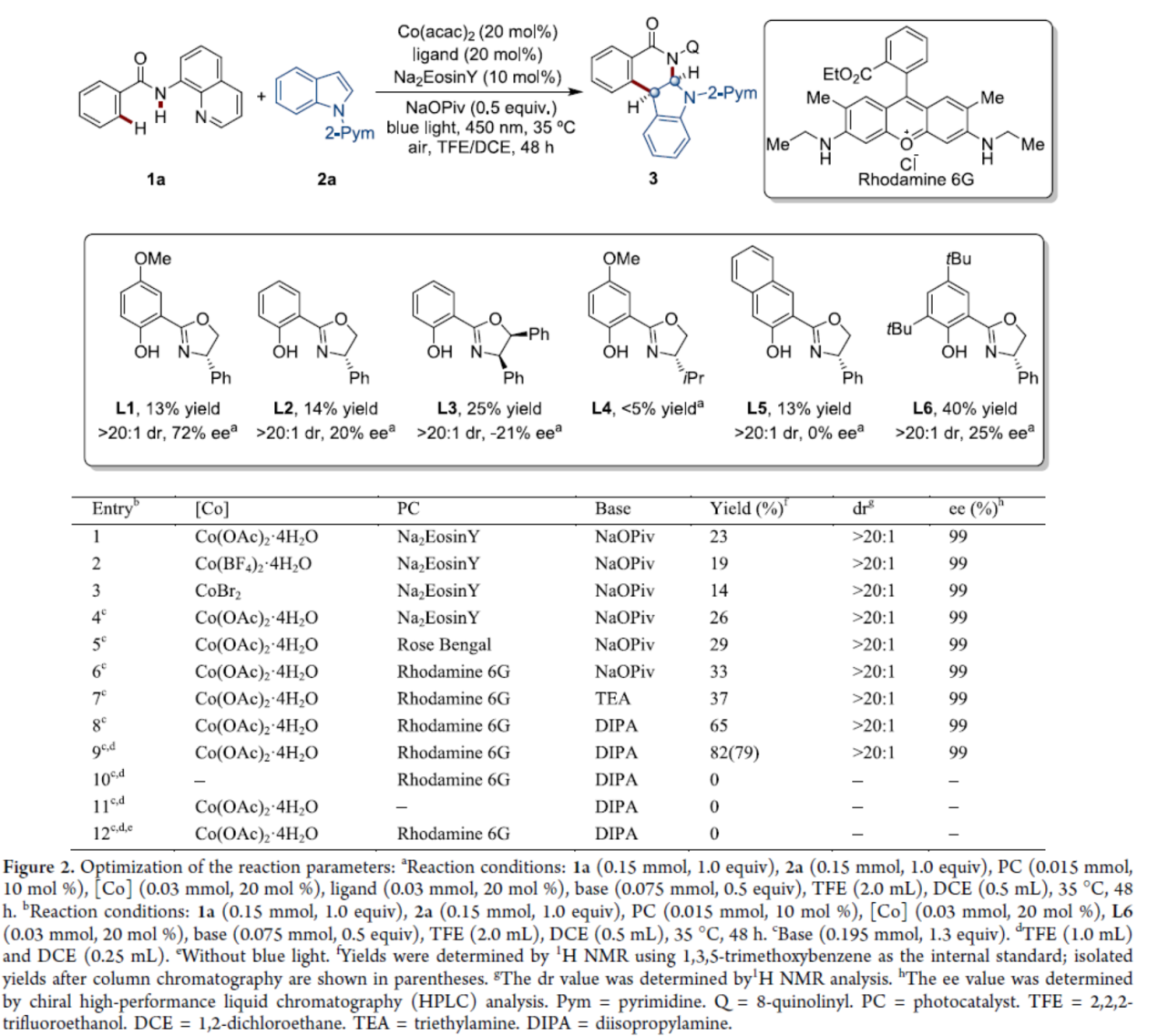
首先,作者以苯甲酰胺衍生物1a与吲哚衍生物2a作为模型底物,进行了相关反应条件的筛选(Figure 2)。当Co(OAc)2·4H2O(20 mol %)作为金属催化剂,Rhodamine 6G(10 mol %)作为光催化剂,L6(20 mol %)作为手性配体,二异丙胺(DIPA,1.3 equiv)作为碱,蓝色LEDs(450 nm)作为光源,在TFE/DCE(体积比为4:1)混合溶剂中35 oC反应48 h,可以79%的分离收率得到产物3,dr > 20:1,ee为99%。
(图片来源:J. Am. Chem. Soc.)
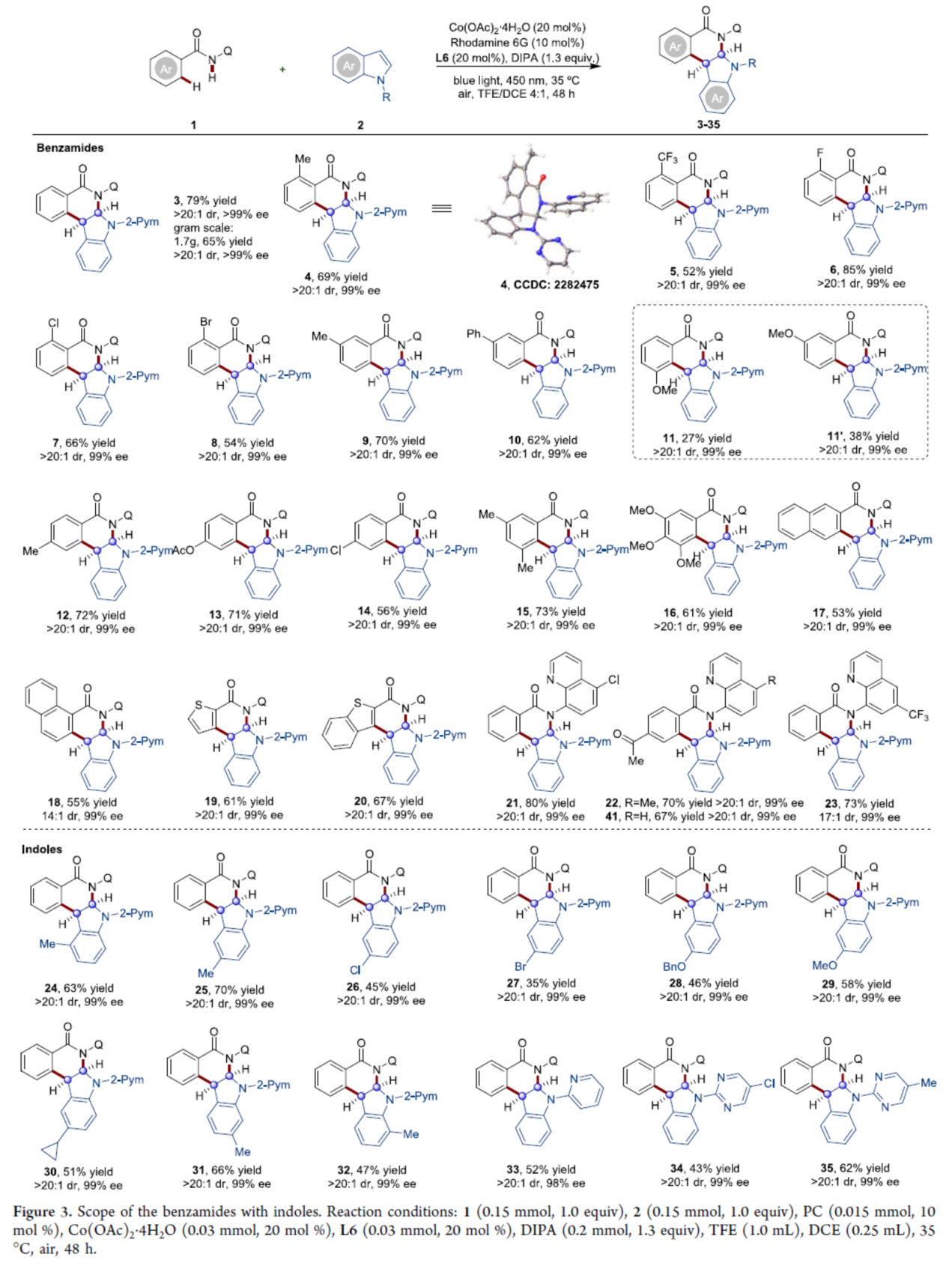
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。首先,当苯甲酰胺底物1中的芳基上含有不同电性基团时,可以中等至良好的收率获得所需的产物4-14,作为单一的非对映异构体,具有优异的对映选择性。其中,对于间甲氧基取代的底物1i,由于甲氧基的强给电子效应和弱的导向能力,获得了区域异构体混合物11(27%收率,99% ee)和11′(38%收率,>99% ee)。二/三取代的N-喹啉基苯甲酰胺以及具有潜在配位硫的杂芳基化合物,也是合适的底物,获得相应的产物15-20,收率为53-73%,dr为14:1->20:1,ee均为99%。5-Cl、5-Me和6-CF3基团取代的氨基喹啉,可以优异立体选择性获得相应的产物21-23,收率为70-80%。其次,一系列不同取代的吲哚衍生物,均可顺利进行反应,获得相应的产物24-35,收率为53-73%,dr > 20:1,ee为98-99%。
(图片来源:J. Am. Chem. Soc.)
紧接着,作者还对反应机理进行了进一步的研究(Figure 4)。KIE实验结果表明,C-H断裂不参与速率决定步骤(Figure 4a)。吲哚2a的一级速率依赖性结果表明,速率决定步骤中涉及插入或还原消除的过程(Figure 4b)。自由基捕获实验结果表明,反应涉及自由基中间体的形成(Figure 4c)。钴环中间体的合成及其化学计量反应研究结果表明,中间体C参与催化循环的过程(Figure 4d)。当向标准反应中加入吡啶时,仅获得12%收率的产物3,表明吡啶具有竞争性配位(Figure 4e)。CV实验结果表明,L6增强了钴(II/III)体系的敏感性(Figure 4f)。
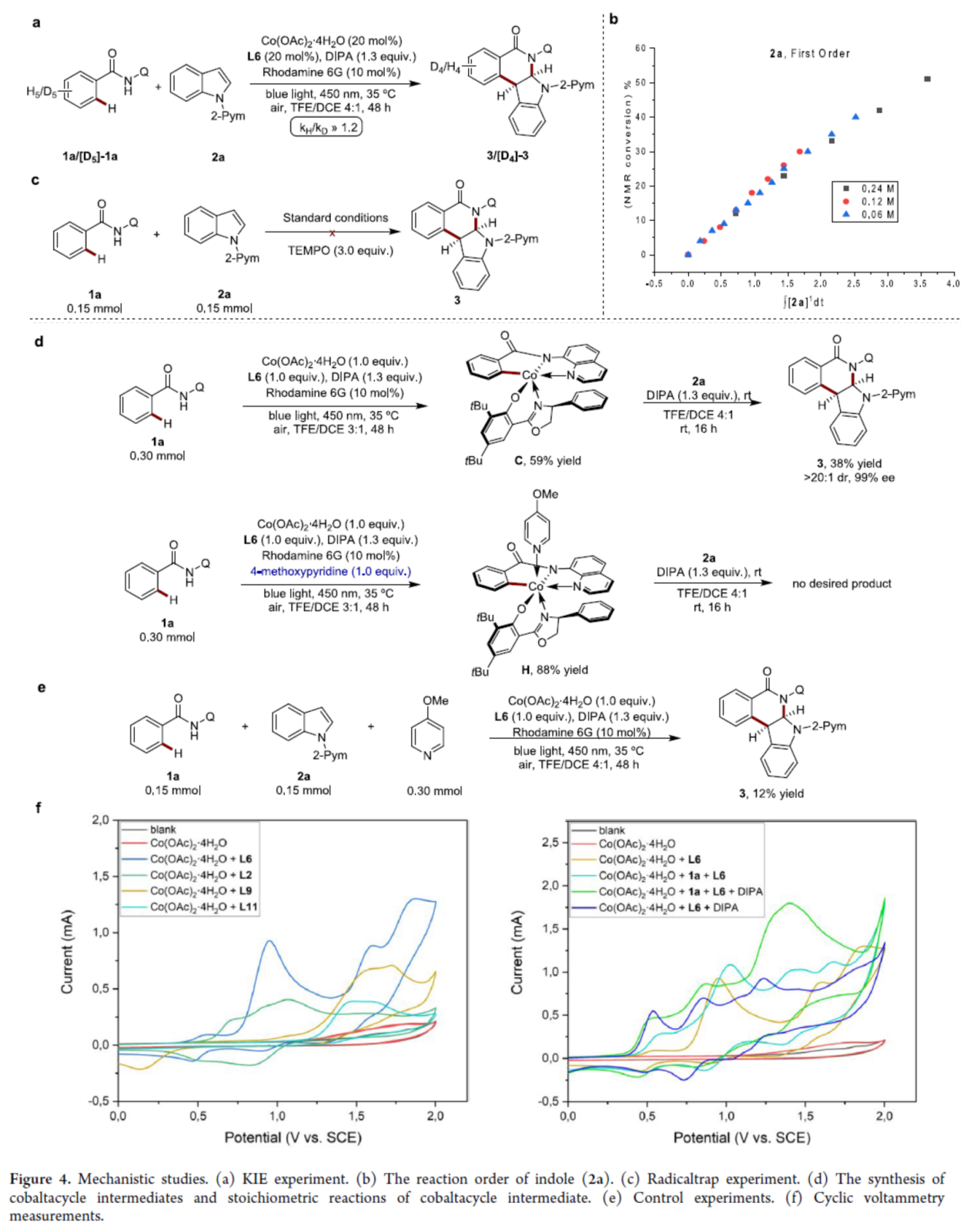
(图片来源:J. Am. Chem. Soc.)
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 5a)。首先,在1a、L6和DIPA的存在下,光激发的Rhodamine 6G氧化钴(II),生成手性八面体钴(III)配合物B。其次,通过对映选择性决定碱辅助的C-H活化过程,生成钴环中间体C。随后,在嘧啶导向基团下,中间体C与2a进行区域选择性迁移插入以及还原消除,生成目标产物3和钴(I)配合物E。此外,在空气氧的存在下,通过Rhodamine 6G在照射下将钴(I)配合物再氧化为钴(II) 配合物,从而再生活性钴(II)催化剂。
最后,作者对反应的实用性进行了研究(Figure 5b)。首先,反应在连续流动条件下成功进行,可以62%的收率得到产物3,dr >20:1,ee 为99%。对于其它的烯烃(如环戊烯和苯乙烯),也可以良好的收率和优异的对映选择性获得相应的产物36和37。值得注意的是,这种连续流动条件对于使用联烯和炔烃构建C-N轴手性也是有效的,如38-40。非活化的烯烃也是合适的底物,尽管对映选择性有所降低(42)。此外,1a和2n的连续流克级规模实验,同样可以70%的收率得到产物36,dr >20:1,ee 为99%,进一步证明了反应的实用性。
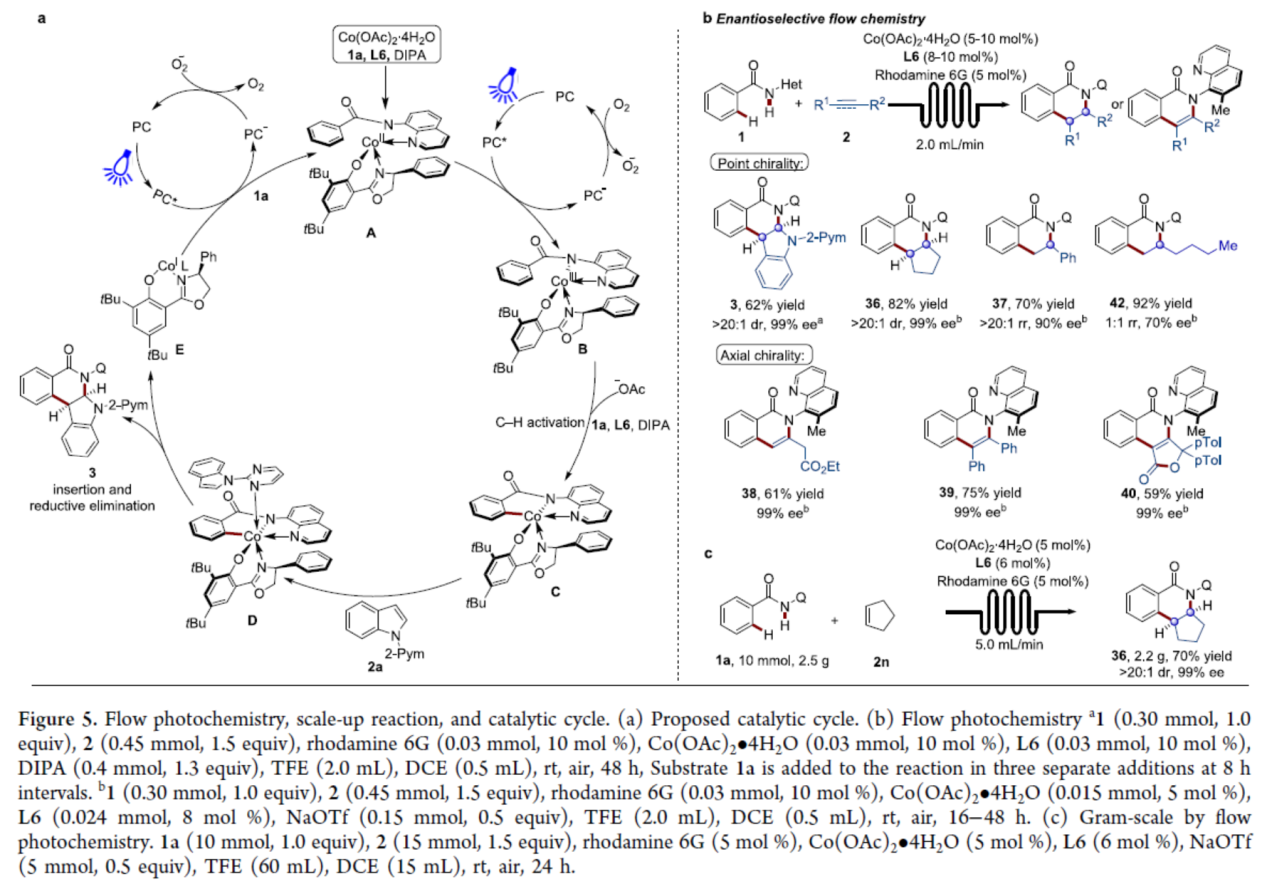
(图片来源:J. Am. Chem. Soc.)
总结
德国哥廷根大学Lutz Ackermann课题组首次报道了一种对映选择性钴光氧化还原催化的C-H活化反应。吲哚的去芳构化促进了区域选择性和立体选择性的C-2和C-3双重官能团化,并为手性吲哚并[2,3-c]异喹啉-5-酮的合成提供了一种高效、直接和高度对映选择性的途径。该策略的成功进一步表明了光化学3d-过渡金属催化对映选择性C-H活化的潜力。在连续的光流动条件下,烯烃、联烯和炔烃的对映选择性环化反应,进而用于合成具有中心和轴手性的化合物证明了其稳健性。







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国