导读
近日,德国马克斯-普朗克研究所(Max-Planck-Institut für Kohlenforschung)Tobias Ritter课题组发展了一个概念上不同的Suzuki-Miyaura交叉偶联反应,其可以在酸性条件下进行,具有广泛的底物范围。实现此过程的关键是在反应偶联配偶体之间形成了一种对酸稳定的钯离子对,且这种离子对不需要碱参与来进行后续的转金属化。值得注意的是,不能直接用于其它Suzuki-Miyaura交叉偶联反应的硼酸,如2-吡啶硼酸和具有强路易斯碱性基团的硼酸均可在此体系下成功实现转化。

(图片来源:Nat. Synth.)
正文
钯催化的Suzuki-Miyaura交叉偶联(SMC)反应是目前制药工业中最常用的碳-碳键构建反应。常用的方法通常需要使用碱,这限制了底物范围。为了避免这一局限性,化学家们开发了耐碱的有机硼试剂、高效催化剂和不需要外部碱参与的反应条件来实现Suzuki-Miyaura交叉偶联反应。然而,仍有许多硼酸不能兼容且必须经历保护才可使用,并且许多具有路易斯碱性的官能团会使催化剂中毒。最近,德国马克斯-普朗克研究所(Max-Planck-Institut für Kohlenforschung)Tobias Ritter课题组发展了一类可在酸性条件下进行的Suzuki-Miyaura交叉偶联反应,反应中形成了对酸稳定的钯离子对,且可以在无需碱参与的条件下进行后续的转金属化过程,从而解决了长久以来Suzuki-Miyaura交叉偶联反应底物的局限性问题(Fig. 1)。
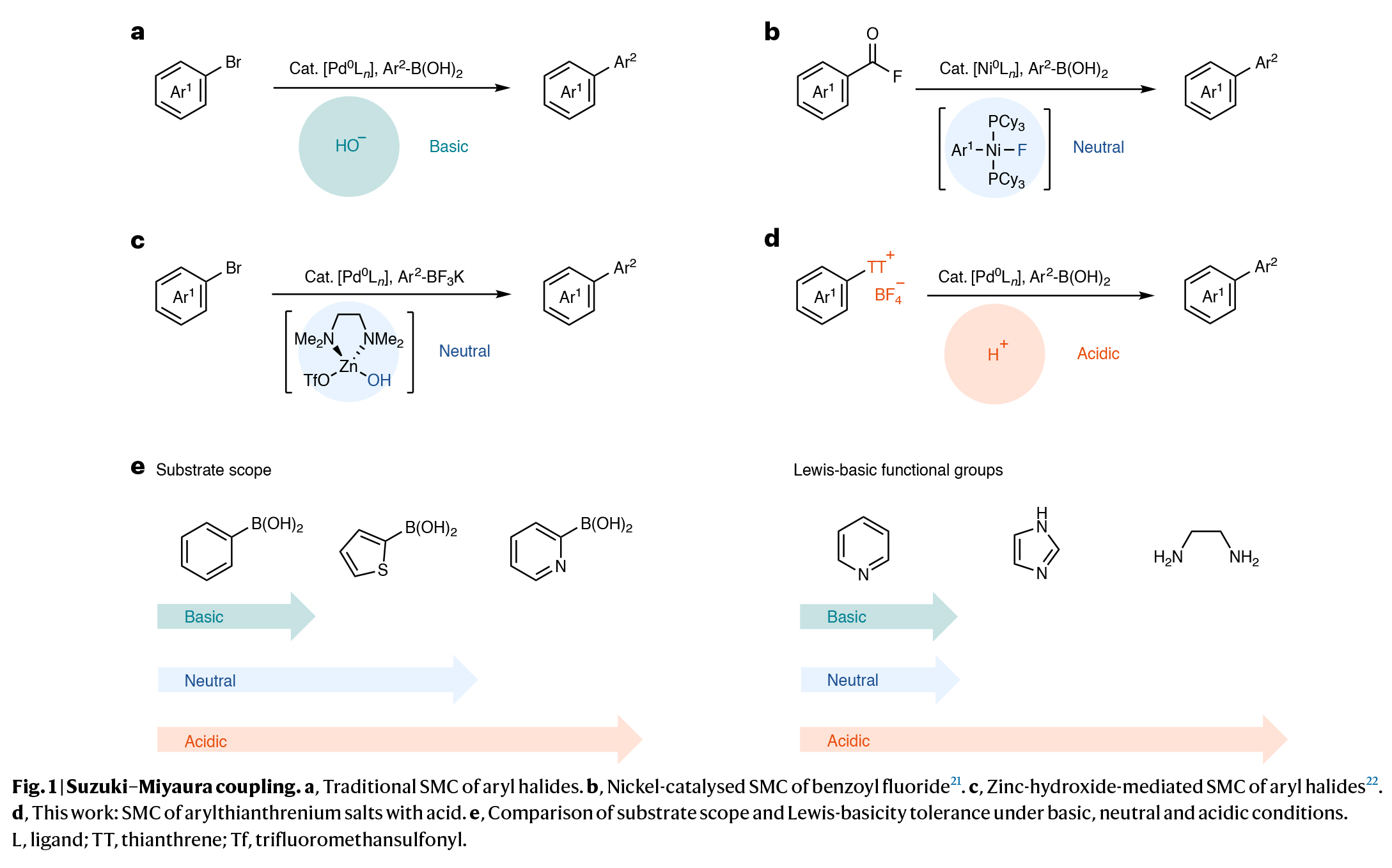
(图片来源:Nat. Synth.)
作者以噻蒽鎓盐1-BF4和苯硼酸作为模板底物对反应进行了尝试。首先,作者使用商业可得的Pd(0)络合物[Pd(tBu3P)2]为催化剂,分别在存在和不存在HBF4时反应。实验结果表明,酸不是交叉偶联过程所必需的,但它是可以兼容的。此类兼容性使得底物在存在路易斯碱性官能团的情况下能够发生反应,因为它们可以在原位通过质子化保护,否则在碱性或中性条件下就不会发生反应(Fig. 2a)。先前的研究表明,当使用芳基卤化物作为底物时,几种碱性的官能团在pH = 3−7下可以兼容。然而,在先前反应条件下失败的各种杂环底物在芳基噻蒽鎓盐的酸性SMC中是可以兼容的。在芳基噻蒽鎓盐的SMC中,是不需要其它SMC反应所需的基本中间体的(Fig. 2b):虽然氧化加成生成了阳离子芳基钯配合物A,但是相应的芳基硼酸会生成芳基三氟硼酸阴离子,或者是中性条件下生成噻蒽鎓盐的四氟硼酸阴离子,或者是酸性条件下生成HBF4(Fig. 2c)。且两种离子中间体均会实现离子对B的生成。阴离子的芳基π-体系和阳离子钯物种可能参与阳离子-π相互作用,这既可以促进B的形成,又可以适应在中性和酸性条件下进行的转金属化过程。具有大位阻的单齿配体[Pd(tBu3P)2]是最佳的钯催化剂,这与离子对形成一致;第二个tBu3P由于位阻而倾向于与A配位,从而为底物的阳离子-π相互作用留下了一个配位位点。过往的研究表明,在氢氧化锌存在的情况下,通过阳离子芳基钯中间体实现硼与钯的转金属化,但在酸存在的情况下该过程并不成功。本文所报道的反应为SMC提供了一种能耐受化学计量强酸的转金属化途径。为了更好理解离子对B的作用,作者评估了不同的酸和不能形成类似离子对的噻蒽鎓盐阴离子(Fig. 2d)。实验结果表明BF4-为最佳,可以以99%产率得到偶联产物2(entry 4)。
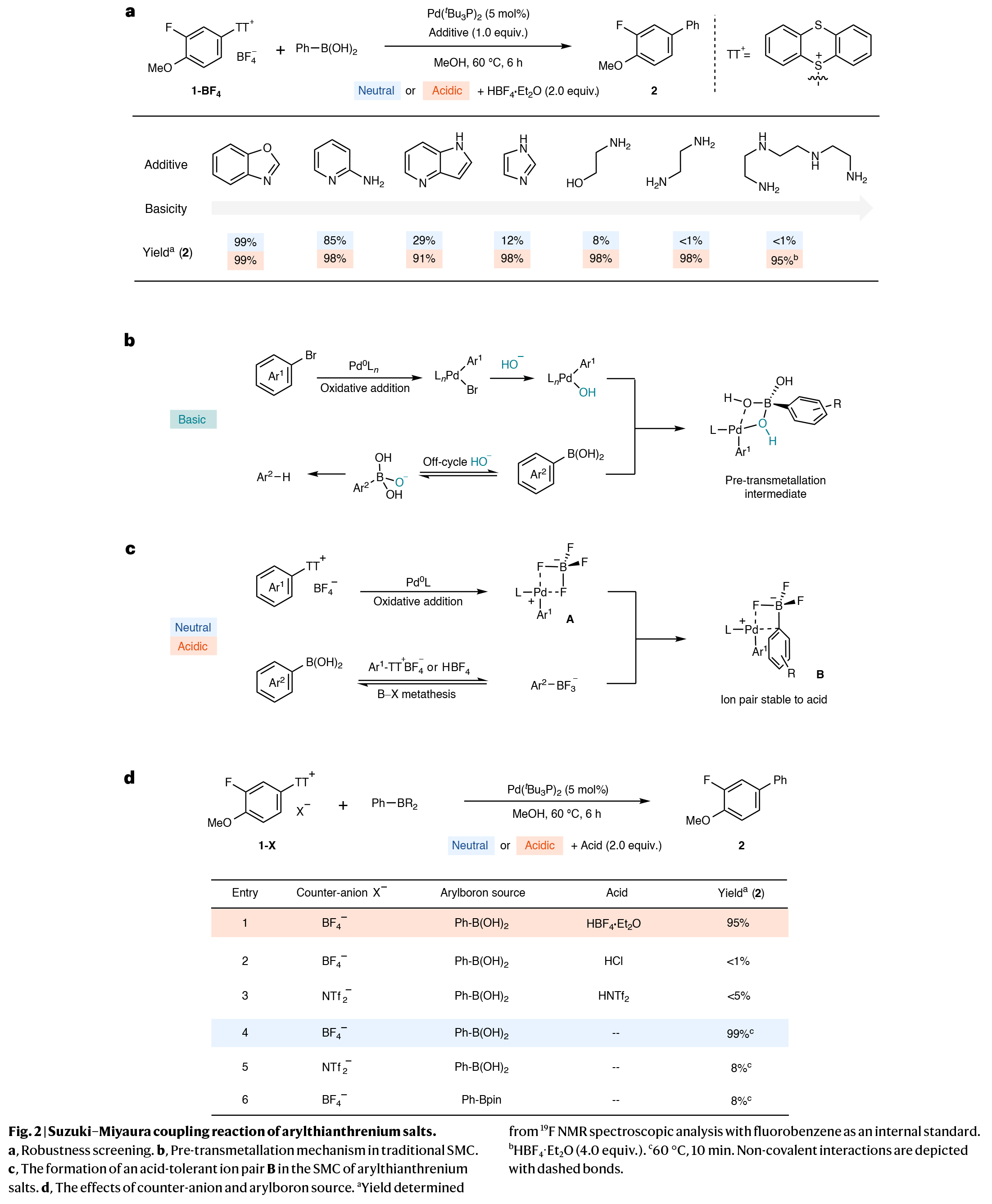
(图片来源:Nat. Synth.)
接下来,作者通过核磁共振研究了苯硼酸与1-BF4和HBF4·Et2O之间的反应,建立了在酸性和中性条件下快速转化为苯基三氟硼酸盐的平衡(Fig. 3a)。在HBF4存在的情况下,1-BF4与钯催化剂的氧化加成可以迅速进行,从而产生钯(II)中间体A(特别是3-BF4)。虽然作者可以从核磁上观察到,但由于其不稳定无法实现分离(Fig. 3b)。实验数据表明,在3-BF4中,BF4-阴离子和钯阳离子之间存在弱相互作用,且作者可以观察到两个离子之间存在的NOE效应,但配体的31P核和阴离子的19F核之间并没有耦合关系。加入苯基三氟硼酸盐后,核磁数据与离子对B的形成相一致。然而,在HBF4存在下,通过内标核磁共振波谱测定,它确实能产生90%的交叉偶联产物2(Fig. 3b)。DFT计算表明,[H]+[Ph-BF3]-和[Ph-PdII]+BF4-(A)之间通过阴离子交换形成离子对B和HBF4,并放出6.3 kcal mol-1的能量(Fig. 3c),并且在B中的Pd-C(ipso)的距离为2.42 Å,与η1配位相一致。关键的B转金属化的活化能为22.5 kcal mol-1,对随后易于发生的还原消除具有周转限制。考虑到这一反应机理,作者还探讨了芳基重氮盐的SMC反应,因为类似的离子对应该也是可以得到的;然而,反应需要提高温度来克服转金属化的活化能垒,而由于芳基重氮盐的热不稳定性,因此导致收率低得多。与芳基重氮盐相比,芳基噻蒽鎓盐是热稳定的,并且考虑到它们在后期官能团化过程中的简单易得性,更容易实现离子对的形成。总体来说,它们需要具备足够稳定和足够活泼的特征。
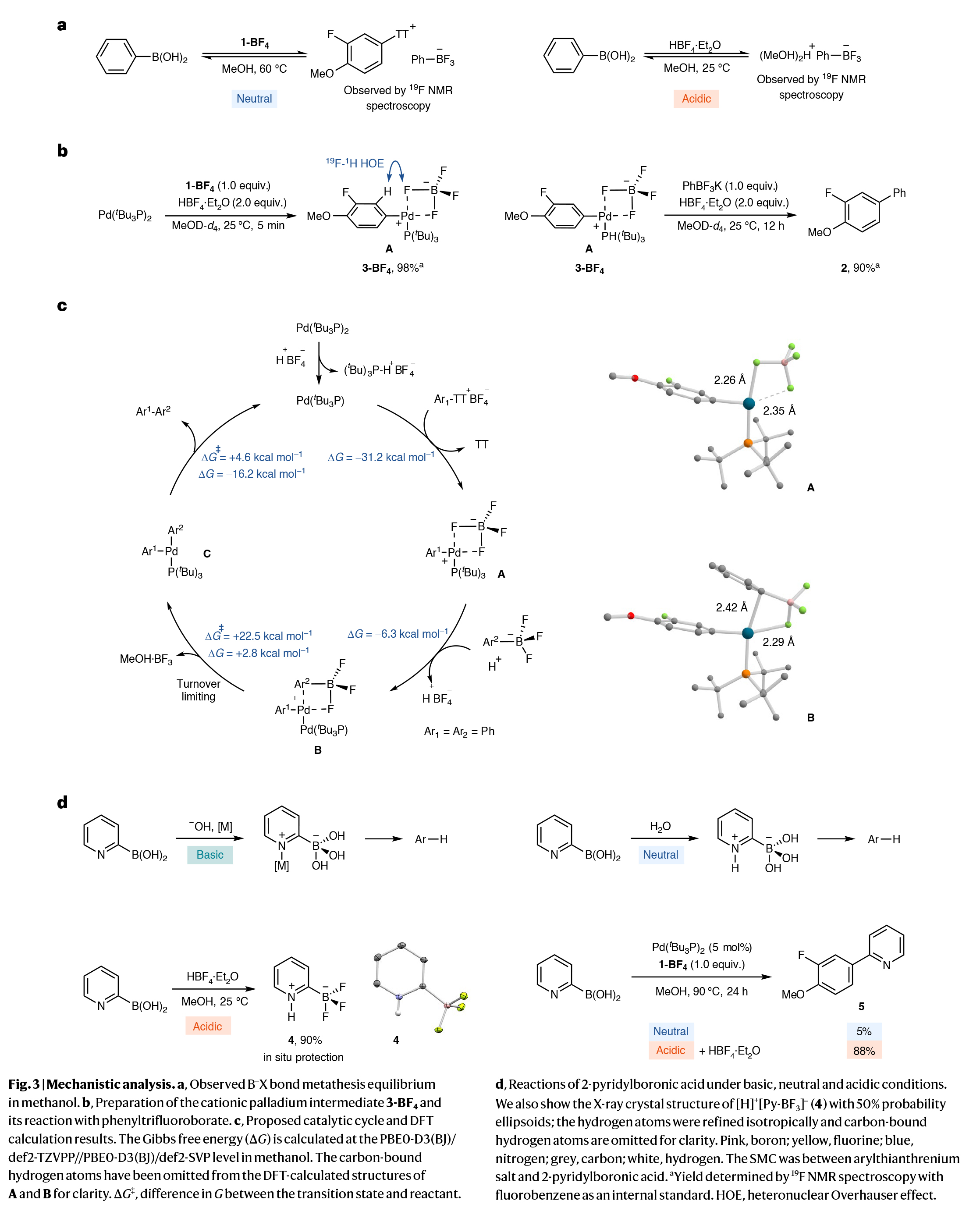
(图片来源:Nat. Synth.)
最后,作者对此转化的底物范围进行了考察(Fig. 4)。总体来说,当使用硼酸作为起始原料时,大量与传统SMC反应条件不相容的底物均可直接参与转化,以61-98%的产率得到相应的偶联产物6-34。其中包括一系列对碱敏感的杂芳基硼酸,如2-噻吩基(18, 20)、2-呋喃基(19)、2-苯并呋喃基(21)、5-嘧啶基(22)、3-吡唑基(23)、2-吡喃基(24)和4-异噁唑基(25)等。值得注意的是,一系列生物活性分子,如clofibrate、nefiracetam、pyriproxyfen和etofenprox等,进一步证明了此转化的实用性。
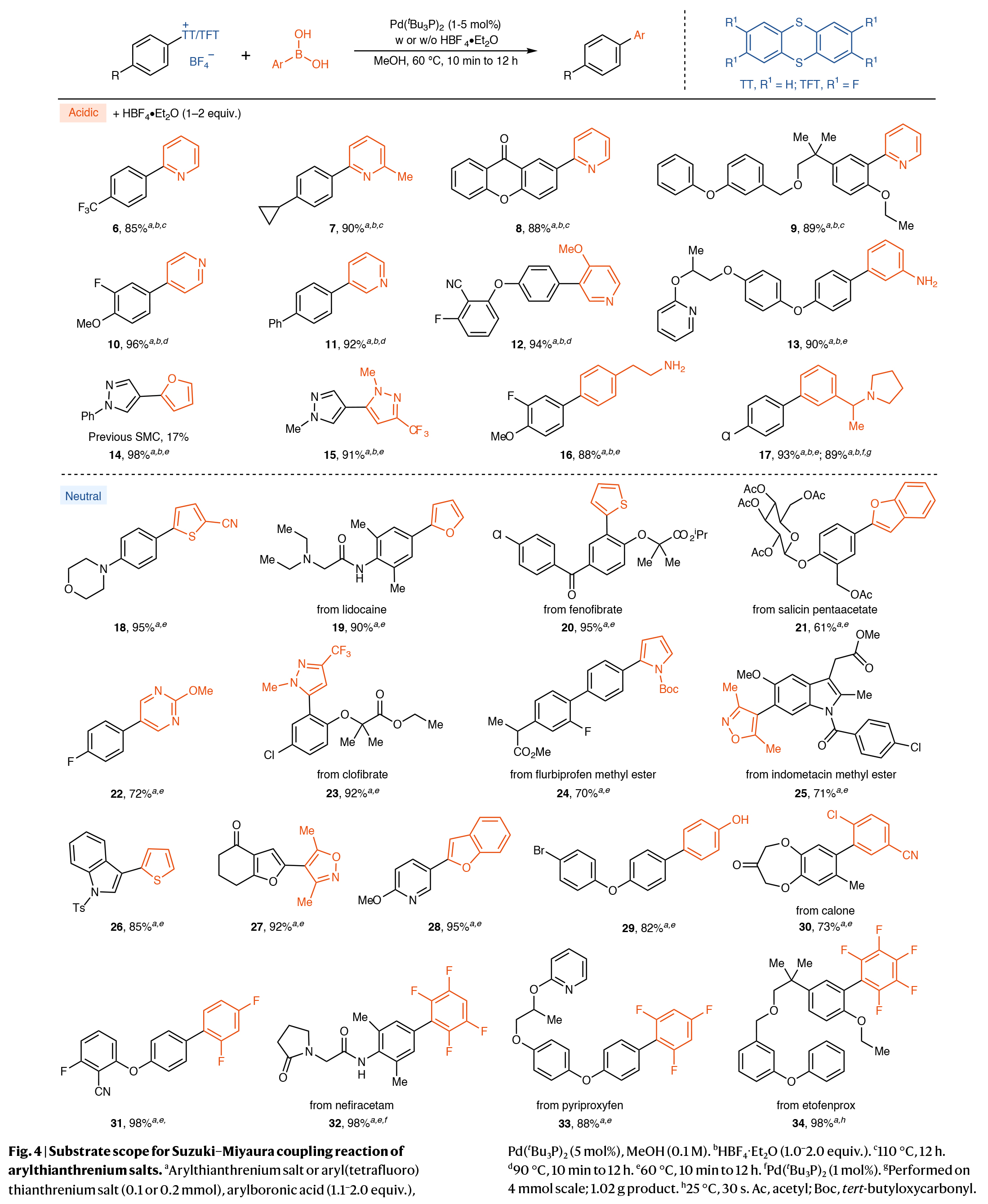
(图片来源:Nat. Synth.)
总结
Tobias Ritter课题组发展了一种不同机理的Suzuki-Miyaura交叉偶联反应,其可以促进酸性条件下C-C键形成反应,而这在其它交叉偶联反应中还未有报道。实现此过程的关键反应的偶联配偶体之间形成了一种对酸稳定的钯离子对,且这种离子对不需要碱来进行后续的转金属化。预计此过程也可以应用在其它涉及转金属化的交叉偶联反应中。
文献详情:
Suzuki–Miyaura coupling of arylthianthrenium tetrafluoroborate salts under acidic conditions,
Li Zhang, Yuanhao Xie, Zibo Bai, Tobias Ritter.
Nat. Synth., 2024
https://doi.org/10.1038/s44160-024-00631-4.







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国