胰腺位于上腹部,在胃的后方,是人体重要的分泌器官。除了可以分泌胰岛素调节血糖水平外,胰腺还可分泌多种消化酶,尤其是胰蛋白酶在蛋白质的消化中有重要的作用。
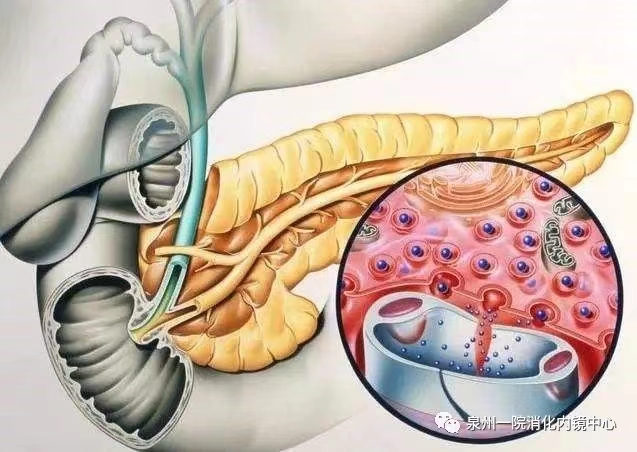
什么是胰腺炎?
各种原因引起胰腺组织损伤,导致原本用于消化食物的各种酶被提前激活,不消化食物,反而消化胰腺自身,这种“自相残杀”的行为引起的一系列后果就是胰腺炎。很多急性胰腺炎的患者都是反复发作多次入院的,因此也是消化科的“老熟人”了。大多数患者为轻型急性胰腺炎,经过适度的补液止痛止吐、尽早经口进食可以使症状快速改善,但仍有20%~30%的患者为重症急性胰腺炎,其为致死性疾病,院内病死率为15%左右。
胰腺炎典型症状有哪些?
(1)急性胰腺炎:①腹痛,上腹痛为主,突然发作,如刀割样;②发热;③恶心、呕吐;④有时可出现皮肤发黄,瘙痒等症状。

(2)重症急性胰腺炎(SAP):在上述症状出现基础上还可有休克、呼吸困难、中枢神经系统症状、消化道出血、DIC等临床表现。
SAP发病机制是什么?
它的发病机制类似脓毒血症,其中细胞因子起关键作用,它介导了全身炎症反应,一旦失控并逐级放大为级联反应,导致MODS。还需要我们大家注意的一点是SAP后期的加重机制,即二次打击。SAP早期引起胰腺自我消化及休克;复杂的加重机制就是胰腺坏死继发感染 全身脓毒血症、双向预激、级联反应从而导致SIRS MODS、MOF等多种并发症的出现。
重症急性胰腺炎应该如何治疗?
社会在发展,时代在进步,胰腺炎的治疗发展也经历了台阶式的发展阶段,从早期手术到现在的以非手术治疗为主,手术治疗为辅的多学科综合治疗。2019 年 6 月发表于世界急诊外科杂志的重症急性胰腺炎管理的国际共识指南中提出由于胰周及腹膜后大量渗出,造成血容量丢失和血液浓缩,又由于毛细血管渗漏存在,需要以动态监测CVP或PWCP及HCT作为指导,进行扩容,并要注意晶体胶体比例,减少组织间隙液体潴留。应注意观察尿量和腹内压的变化,同时注意维护机体的氧供和内脏功能监测。支持治疗,尤其是防止低氧血症和保证充分补液,是急性胰腺炎患者治疗的关键。第二个方面是通过禁食、胃肠减压、抑酸等使胰腺得到充分休息。急性胰腺炎患者预防性使用抗生素不能降低病死率或改善病情,因此不推荐所有急性胰腺炎患者常规预防性使用抗生素。建议在病程3天内进行的增强CT扫描,以尽早明确胰腺坏死面积以及是否合并胆系结石,如有胰腺坏死面积≥30%或胆源性胰腺炎立即予预防性使用抗生素干预。在SAP发病1-3周内预防使用抗生素是最佳时机。预防性使用抗生素10-14天是合理的。一般不超过21天。
可选择的抗生素种类有哪些?
酰脲类青霉素和3代头孢针对革兰氏阴性菌有效。哌拉西林他唑巴坦对革兰氏阳性菌和厌氧菌有效。喹诺酮类药物(环丙沙星和莫西沙星)和碳青霉烯类都显示出良好的渗透至胰腺的能力,并可覆盖厌氧菌。
重症胰腺炎的营养支持治疗
SAP的营养支持贯穿整个病程,20世纪80年代--SAP发病后一个月90年代中后期逐渐提前至患者入院后2周最近提出在患者入院后5-7d就开始,甚至早至入院后2-3d。SAP患者需要营养支持,应该在其生命体征平稳、血流动力学和内环境稳定的前提下进行。一旦胃肠功能恢复,应及时给予肠内营养(EN),想方设法建立EN通路。尽管EN和肠外营养(PN)在病死率和疼痛评分上无区别,但是可以改善预后,减少感染相关的并发症的发生率和治疗费用。
众所周知,胃和十二指肠传送营养可以明显增加胰液的分泌,但空肠内输注营养却不增加胰液分泌,肠内外营养(TPN)有许多不利的影响(如导致感染肠粘膜屏障的损害等),肠内营养越来越受到重视。研究表明在胰腺炎的急性期,在内镜引导下放置空肠营养管到Treitz韧带下方,输注肠内营养,有效地克服胰腺炎症坏死所致的胃十二指肠动力障碍,在发病后48小时内经鼻空肠管输注肠内营养,病人也能很好的耐受,并未发现有不良的临床反应与TPN相比。早期肠内营养明显降低感染等并发症。无论从有效性、病人的耐受程度、临床结果和费用等方面,均提示肠内营养空肠途径更有利于重症急性胰腺炎。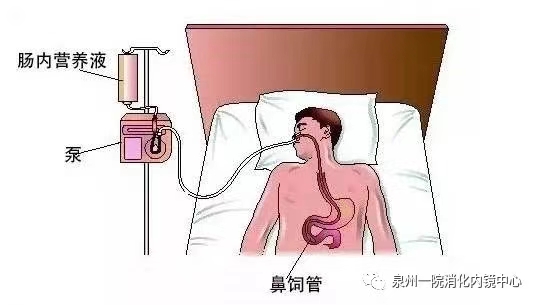
重症急性胰腺炎的营养支持难点
早期营养支持很重要,但心、肺功能往往不能耐受大量液体负荷,同时糖代谢障碍、胰岛素耐受,营养支持只能以提供必须的营养底物、不增加脏器负荷为原则,早期无法强求充分的热卡提倡早期肠内营养已经达成共识,但SAP早期常合并胃、十二指肠功能障碍,使其难以实施且实施的时机仍存在争议。






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国