诱导性多能干细胞(induced pluripotent stem cells,iPSCs),是指通过对体细胞进行重编程,让分化的体细胞“返老还童”,成为类似人胚胎干细胞(ESCs)的多能性干细胞。这项发现最早是2006年,由日本京都大学Shinya Yamanaka在Cell杂志上报道的,一经问世,便引起了巨大的反响。在这十多年中,iPSCs技术飞速发展,目前已经应用到疾病模型构建、药物筛选和细胞治疗等多个领域,并且都具有广泛的应用前景。
iPS细胞在疾病模型中的应用
传统的疾病模型不管是动物模型、原代细胞还是细胞系都存在一定的局限性,比如动物与人类生理上存在差异性,细胞系遗传上的变异,使用胚胎干细胞或者原代细胞带来的伦理问题等等。而iPSCs完美地解决了这一系列的问题。不仅细胞来源容易获得,遗传性稳定,能大量扩增,而且可以诱导分化成各种体细胞,这些特征无疑让iPSCs在模拟人类疾病上具有不可取代的优势。
iPSCs疾病模型建立过程如图1所示。首先,将患者的体细胞,比如血液的单核细胞或皮肤组织的纤维细胞,通过基因重编程的方式将体细胞转变成为iPSCs。再将iPSCs诱导分化为特定的细胞类型,如神经细胞、肝细胞、心肌细胞等,以此模型为基础可以对分化后的细胞进行特定的研究。此外,可以利用基因编辑技术(如CRISPR–Cas9)生成同基因型的对照组。此种方法产生的对照组细胞系除了致病基因外,拥有与患者完全一样的遗传背景。
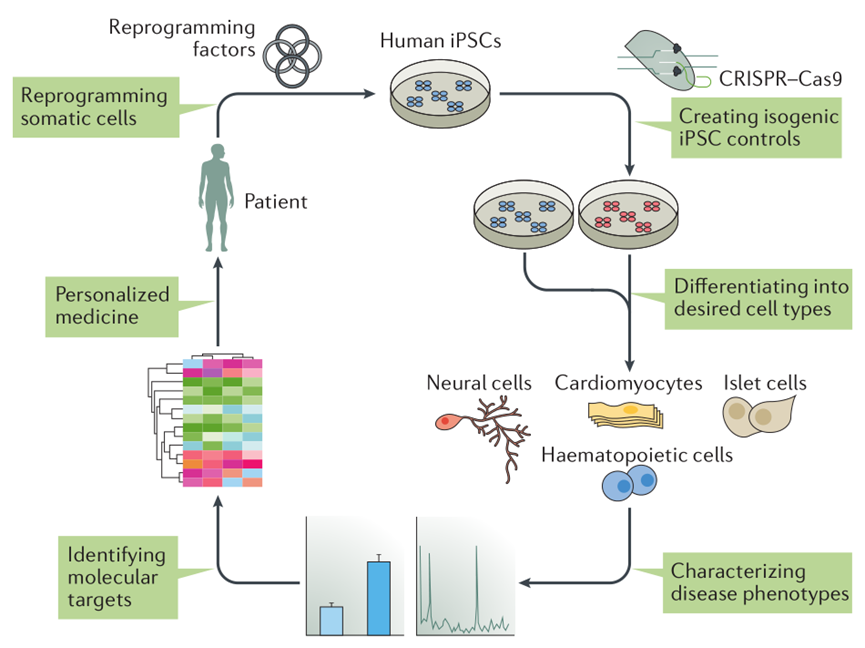
图1 人类iPSCs疾病模型构建示意图 (Shi et al., 2017)
iPS细胞在药物筛选中的应用
新药研发过程中,在进入临床阶段研究前,需要对候选药物的活性、药理和毒理作用进行评估。但是由于传统的动物模型或细胞模型和实际人体的生理情况存在差异,永生化的细胞系或肿瘤细胞衍生的细胞系在遗传上已经发生改变,甚至有些无法反应出相关疾病的分子机制,会直接导致新药开发在临床试验阶段的高失败率,很大程度的限制了新药的研发进展。
iPSCs技术的出现为新药筛选开辟了新道路。将患者来源的iPSCs大量分化为与疾病相关的靶细胞,利用这些细胞进行药物小分子高通量筛选。与传统动物模型相比,iPSCs的细胞制备和培养周期短,且遗传背景与人体一致等特点。这显著提高了新药研发的效率和准确率,也降低了成本。目前,基于iPSCs的药物筛选已被用于多种疾病超过1000种化合物筛选中,包括帕金森、精神分裂症、肌萎缩性侧索硬化、阿尔茨海默症、亨廷顿舞蹈症以及心脏病、肌肉营养不良等,多种潜在的临床候选药物已被发现。
iPS细胞在再生医疗中的应用
基于干细胞的再生医学一直以来都备受追捧,潜力巨大,干细胞的来源也是一直在不断的探索之中。人类胚胎干细胞(ESCs)可以分化成各种体细胞,是临床细胞治疗的潜在来源,然而,ESCs除了获取困难之外,还面临免疫耐受的缺乏。尽管ESCs在未分化状态下可能具有免疫“豁免”特权,但分化后的细胞却会触发细胞和体液免疫反应,存在很大的排异风险,有的甚至需要终身免疫抑制治疗,不仅副作用大,而且成本也高。而从自体获得的iPSCs就可以避免这个问题。iPSCs与胚胎干细胞一样拥有多种分化潜能,而且取自患者自身体细胞(如血液、皮肤等),获取容易,分化出的细胞用于患者治疗排异风险小。因此,iPSCs在再生医疗领域拥有巨大的潜力。
目前,iPSCs通过分化,它们可以生成血细胞、骨细胞、神经细胞等200多种细胞。理论上,iPSCs可以分化出人体任何特定的细胞类型。在临床应用上,基于iPSCs的细胞治疗在黄斑变性、色素性视网膜炎、帕金森、心脏病、糖尿病和癌症等疾病上都取得一定的进展。一般来说,iPSCs治疗可以分为六个步骤(图2)。首先,从受影响的患者处收集体细胞并进行培养,将这些体细胞重编程为iPSCs。然后,利用基因编辑技术或病毒转导方法对患者衍生的iPSCs进行基因修复。随后,将修复后的iPSCs分化为所需的细胞类型,以提供基因匹配的健康供体细胞。接下来,对这些细胞进行细胞鉴定、纯度、活性和安全性的质量控制测试。最后,将这些的健康细胞移植到患者体内进行细胞治疗(图 2)。
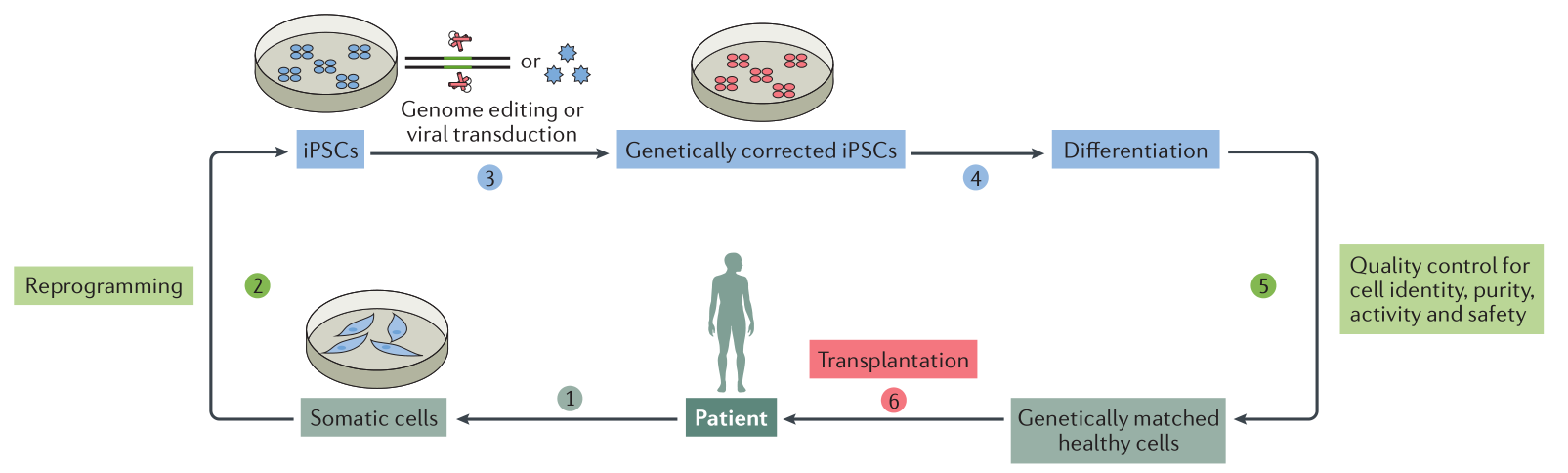
图2 基于人类 iPSCs 的细胞疗法示意图 (Shi et al., 2017)
然而iPSCs疗法的广泛应用还面临诸多挑战,其中最主要的顾虑之一就是肿瘤形成风险。由于多能干细胞在培养过程中可能出现核型异常、拷贝数变异以及杂合性丧失等,因此在临床使用之前,iPSCs来源的产品需要经过严格筛查,确保其没有潜在的遗传改变,并且必须经过严格的纯度、质量和无菌性检测。尽管尚无证据表明分化自iPSCs的产品能够生成畸胎瘤,但为了避免这一风险,必须确保最终产品中不含未分化细胞。目前,研究人员也正在开发更精细化的分化方案,来确保分化目标的准确性,比如通过流式细胞仪对分化细胞进行分选,排除掉未分化的细胞。另外,研究者还开发了一些能够选择性杀死未分化多能干细胞的小分子抑制剂等。鉴于iPSCs建立周期较长,这一方法目前可能无法适用于疾病进展迅速的患者。
iPSCs技术发展现状
据2023年弗若斯特沙利文发布的《诱导多能干细胞(iPSC)产业现状与未来发展蓝皮书》,全球已有多家公司拥有iPSCs产品,但多数产品均处于临床前研究阶段 (图3)。其中,Cynata Therapeutics的CYP-004是全球首个进入临床III期的iPSCs产品,该公司另一项产品CYP-001也已进入II期临床试验。日本Heartseed公司的产品同样进入临床I/II期,并于2021年被诺和诺德收购。此外,Fate Therapeutics和BlueRock Therapeutics的iPSCs产品也处于临床I/II期。
根据公开数据显示,目前全球在研iPSCs产品主要集中在肿瘤、帕金森病、眼科疾病、心力衰竭、Ⅰ型糖尿病、骨/关节疾病等,其中帕金森病、心力衰竭、骨/关节疾病、移植物抗宿主、血液瘤已经进入临床试验阶段。未来,随着研究不断深入,覆盖的适应症将持续扩大。
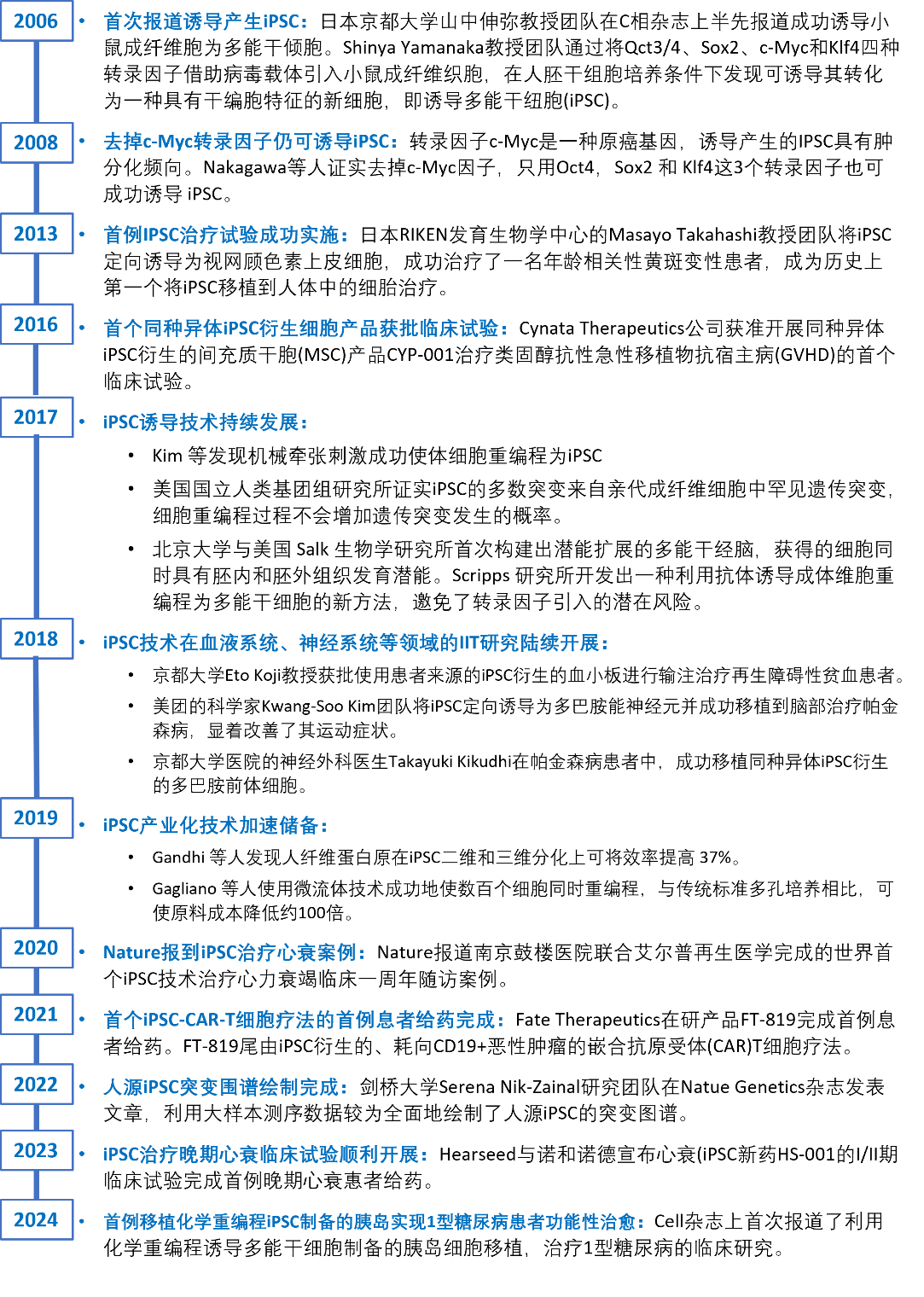
图3 iPSCs技术发展历程
总体而言,iPSCs技术在建立疾病模型、药物筛选和临床治疗领域已显示出一定的成熟度。未来,随着iPSCs技术的不断发展,也正逐步拓展到干细胞与组织工程、类器官培养、以及器官移植等创新领域,在医疗行业领域中展现更大潜力和价值。
重庆医科大学附属儿童医院iPS细胞研究中心
何文婷
参考资料:
1. Shi Y, Inoue H, Wu JC, Yamanaka S. Induced pluripotent stem cell technology: a decade of progress. Nat Rev Drug Discov. 2017;16(2):115-130. doi:10.1038/nrd.2016.245
2. Nicholson MW, Ting CY, Chan DZH, et al. Utility of iPSC-Derived Cells for Disease Modeling, Drug Development, and Cell Therapy. Cells. 2022;11(11):1853. Published 2022 Jun 6.
3. Engle SJ, Blaha L, Kleiman RJ. Best Practices for Translational Disease Modeling Using Human iPSC-Derived Neurons. Neuron. 2018;100(4):783-797.
4. 若斯特沙利文,《诱导多能干细胞(iPSC)产业现状与未来发展蓝皮书》,2023.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国