出品:科普中国
作者:Clover青子(医学博士)
监制:中国科普博览

一名参与者将手放在一桶冰中,测试人员利用工具测量他的疼痛反应。
(图片来源:Ruby Wallau/Northeastern Univ)
大家可能听过这样的说法,“蚊子咬是1级疼,生孩子是10级疼”。
疼痛真的能这样分级吗?
在上一篇中,我们探讨了人们对疼痛的不同感受,每个人对疼痛的体验都不尽相同,它注定是非常主观和难以量化的。2016年,美国美国佛州17岁女孩Maya因罕见的复杂性区域性疼痛综合征入院。母亲Beata提出使用镇痛疗法,却被医护人员怀疑其为“代理型孟乔森综合症”(一种让护理者虚构或诱发孩子症状的心理障碍)而遭拒。母女被迫分离,Beata在压力和无助中选择自杀。这起悲剧性事件暴露了医疗系统在疼痛测量和诊疗方面的不足。
如果不进行测量,就无法管理疼痛,甚至无法研究疼痛。医生主要依靠患者自我报告的主观测量方法来评估疼痛,科学家也在开发基于生理信号的客观测量方式。
它们究竟有什么差异,能帮助我们彻底量化疼痛吗?量化疼痛就意味着能够治疗疼痛了吗?看完本文你就知道了。
主观量表与患者自评
患者的自我报告是向医务人员描述疼痛的常用方式。NRS(数字评分量表,Numerical rating scale)和VAS(视觉模拟量表,Visual analog scale)是医生最常用的工具。本文开头提到的疼痛分级就是NRS。
NRS是常用的数字评分工具,通常范围是0到10,0表示没有疼痛,10表示剧烈的疼痛。由于其操作简便,NRS在临床中应用广泛。VAS则通过让患者在一条10厘米的水平线上标记自己感受到的疼痛位置,来反映疼痛的强度,得出的分数以厘米表示。这一方法比NRS更精细,但要求患者具备一定的理解能力。
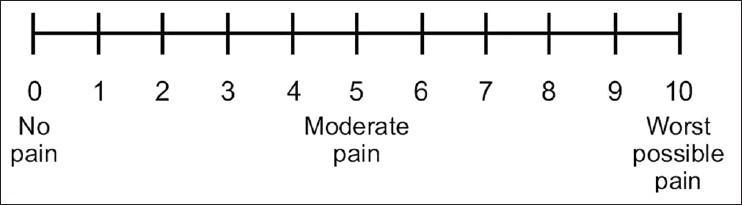

NRS和VAS量表示意图
(图片来源:European Pain Federation EFIC 2022)
面孔疼痛量表(有时称为笑脸疼痛量表)使用六张面孔来衡量3-8岁儿童的疼痛。儿童被要求指出最能代表他们疼痛程度的面部,从左边没有疼痛的面部一直到右边有疼痛剧烈的面部。
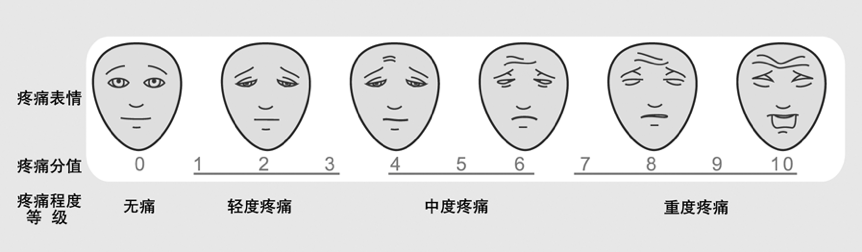
面部表情疼痛量表
(图片来源:癌症疼痛诊疗规范2018年版)
这几种方式都是一维的工具,很适合用来评估急性疼痛。但由于慢性疼痛比急性疼痛涉及更复杂的身体、心理和社会损伤,因此建议进行多维测量。
McGill疼痛问卷就是一个例子,它通过多维度评估疼痛的不同方面,第一层面的感觉维度患者需要选择合适的词汇来描述他们的疼痛性质,如“刺痛”“灼痛”“酸痛”等,描述疼痛的具体特征。另一方面是情感维度,评估疼痛对患者情感和心理的影响,最后才是结合NRS或者VAS的总体评价。它的理念是“疼痛不仅仅是一种感官体验,它还包含情感、心理和认知等多个方面”。
当患者无法交流他们的主观疼痛体验时,必须采取替代措施。包括对疼痛行为和反应的观察,这些行为和反应可能表明患者有疼痛。如针对婴儿的FLACC量表,其中面部表情、腿部位置、活动、哭闹和可安慰性进行评分。再比如新生儿面部编码系统,其中疼痛表达通过面部肌肉的判断进行量化,例如眉毛凸出、眼睛挤压。
总的来说,疼痛评估将取决于患者的疼痛持续时间(急性与慢性)、疼痛状况和类型(如癌症、背痛、神经性疼痛)、人群类型(如儿童、认知障碍患者)以及患者的价值观、目标和偏好。不同的这些量化工具有助于医生理解患者的疼痛体验,但同时也存在局限性,因为这些量表都基于主观评估(他人观察也是一种主观),不同患者对同一疼痛等级的理解可能完全不同。
生理信号与疼痛的客观测量
研究人员和临床医生一直在努力寻找一种客观的疼痛测量方法或生物标志物,以用于诊断、治疗、预后及药物开发等领域。然而,至今尚未有完全确立的量化疼痛的客观方法。
科学家们正探索多种方法,包括脑成像、生理信号监测和生物标志物分析。你或许听说过功能性磁共振成像(fMRI),它就像是大脑的“透视镜”,可以捕捉不同类型疼痛时大脑的活动模式。这些技术能显示出我们在感受疼痛时,大脑中的哪些区域被激活。不过,问题在于fMRI的操作成本高、技术复杂,不能像血压仪那样可以随时随地使用。
那么,有没有更加简便的方法呢?
研究人员开始通过检测人体的生理信号来寻找疼痛的线索。
PMD-200床边监护仪就是这样一个设备,通过手指探针收集一个人的心率、皮肤水分、运动和温度等生理反应,并将这些信号转化为疼痛评分。在美国被授权仅用于处于麻醉状态且无法交流其疼痛程度的患者的手术中。
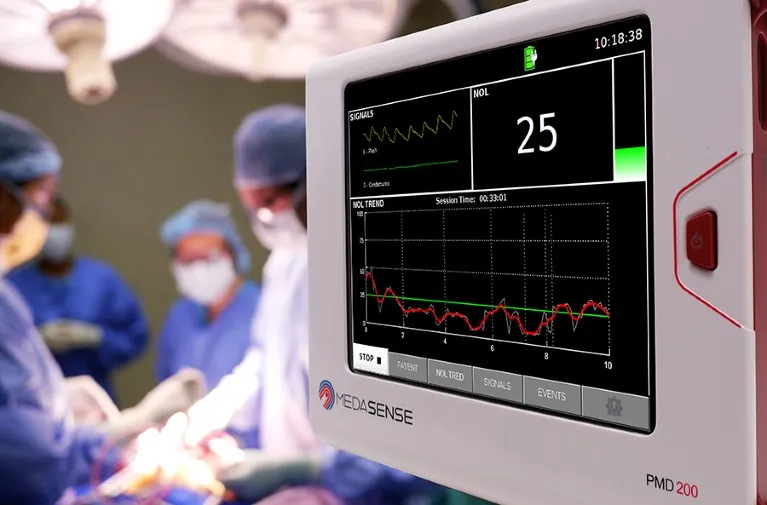
PMD-200床边监护仪是美国食品药品监督管理局唯一授权的疼痛测量设备。
(图片来源:Medasense)
还有更便捷的设备:一种手持设备能够扫描眼睛并测量电刺激下瞳孔的扩张,利用三种电频率激活不同的感觉神经纤维,将信号传递至大脑,导致瞳孔变化,根据反射的差异性创建疼痛特征。该设备已经在炎症疼痛患者中进行了测试。
另一种可穿戴贴片通过监测前额大脑表面的血流变化,实时测量神经元活动,并将其转化为疼痛指数,涉及130名经历分娩疼痛女性的试验数据显示,该设备与患者自述疼痛的匹配度约为80%。

AlgometRx设备可以通过扫描某人的眼睛来创建疼痛特征。
(图片来源:AlgometRx公司)
另一个研究团队开发的纳米级生物传感器可测量血液中的两种生化化合物——环氧合酶-2(COX-2)和诱导型一氧化氮合酶(iNOS),只需采集患者的指尖血样进行分析就能够在几分钟内获取易于理解的结果,首次临床试验非常成功。
这些正在开发中的疼痛测量方法,使得疼痛测量越来越轻便化,更无创,更具有实用性。但遗憾的是,目前仍然没有一个公认的客观疼痛指标。当然,这并不意味着对疼痛生物标志物的追求是徒劳的,一种可靠的测量方法仍然可以帮助临床医生更好地评估、分类和跟踪疼痛。
需要注意的是,主观量表和客观测量不是非此即彼的,我们不能仅凭感觉神经元的活动就断定疼痛的存在或不存在,同时还要考虑经历疼痛的人对疼痛强度和严重程度的自我描述。未来的疼痛管理将依赖主观报告与客观测量的结合,通过两者的互补,为患者提供更精准和个性化的疼痛测量方案。
疼痛治疗的生物标志物
尽管主观和客观的疼痛评估提升了医生对疼痛的理解,然而,找到真正合适的治疗方案往往超出这些评估的范围。
我们如今有多种高质量的疼痛治疗方法可供选择,但找到最适合每个患者的治疗方案仍然是个艰难的过程。对于很多患者而言,治疗更像是在迷宫中寻找出口,需要逐一尝试不同的药物和疗法,直到找到正确的方向。这种方法不仅耗时费力,还让患者常常感到失望和沮丧。

慢性疼痛的精准疗法也许可以帮助人们从一开始就选择有效的治疗方案。
(图片来源:Daniel Stolle for Nature)
这时,人工智能(AI)为我们带来了新希望。AI技术已经开始在疼痛管理中展露头角,分析患者的脑电图,不仅能区分慢性下背部疼痛患者与健康人群,还能预测哪些患者会从脊髓刺激器中受益,准确率接近80%。
AI算法可以从脑电图信号中预测疼痛状态。
(图片来源:萨博实验室克利夫兰诊所)
另一个研究团队利用机器学习分析不同类型的疼痛刺激(如针刺、热、触摸)的反应,发现可以将患者分为不同的“亚型”,每种“亚型”患者的疼痛表现和治疗需求可能存在差异,这样的划分有助于医生更准确地理解不同类型患者的需求,从而帮助医生制定更加个性化的治疗方案。
疼痛管理领域正向数据驱动的个性化治疗方向发展。比如,CHOIR系统通过标准化方式收集患者的疼痛数据,跟踪他们对不同药物的反应,为AI模型提供数据支持,帮助医生预测治疗效果。然而,这一技术还处于早期阶段,建立数据库需要大量时间和资源。此外,尽管AI提高了预测的准确性,当前的AI模型仍然缺乏足够的可解释性,因此医生必须结合个人经验和患者反馈来优化治疗。
人类疼痛的异质性太大,找到适合所有人的“超级止痛药”根本不可能,但通过寻找生物标志物,为每个患者找到已有药物中的最佳选择,是可能实现的。
期待一种“万能”且客观的疼痛测量方法
疼痛测量一直是个棘手的问题,尽管科学家不断尝试通过生物标志物和客观工具来量化疼痛,但痛苦终究是一种独特而个人化的体验。自我报告仍然是评估疼痛的主要方式,而且医生们也越来越关注疼痛对生活质量的影响。
虽然找到“万能”疼痛生物标志物的路还很漫长,但这并不妨碍我们对未来的期待。也许有一天,医生可以通过几分钟的检测就能精准推荐治疗方案,而不是靠“试药”这个有点像盲盒的过程。
下期让我们继续探讨传统疼痛治疗的局限性及非药物治疗的最新进展,敬请期待。
参考文献:
1.Roedel, A. (2023) An allegation of Munchausen by proxy, a mom’s suicide, a daughter’s pain: ‘take care of maya’ exclusive clip, People.com. Available at: https://people.com/allegation-of-munchausen-by-proxy-mom-suicide-and-daughter-pain-take-care-of-maya-exclusive-clip-7510301 (Accessed: 01 November 2024).
2.Measuring pain in the clinic (2024a) European Pain Federation. Available at: https://europeanpainfederation.eu/measuring-pain-in-the-clinic/ (Accessed: 29 October 2024).
3.Mogil, Jeffrey S. “The history of pain measurement in humans and animals.” Frontiers in pain research (Lausanne, Switzerland) vol. 3 1031058. 15 Sep. 2022.
4.Mitchell Crow, James. “Could biomarkers mean better pain treatment?” Nature vol. 633,8031 (2024): S28-S30.
5.Dolgin, Elie. “How a 'pain-o-meter' could improve treatments.” Nature vol. 633,8031 (2024): S26-S27.
6.Sadik, Omowunmi, et al. "A Bayesian network concept for pain assessment." JMIR Biomedical Engineering 7.2 (2022): e35711.
7.Orzabal, Marcus et al. “A Forehead Wearable Sensor for the Objective Measurement of Chronic Pain.” International journal of environmental research and public health vol. 19 (2022),24 17041.
8.Levitt, Joshua et al. “Pain phenotypes classified by machine learning using electroencephalography features.” NeuroImage vol. 223 (2020): 117256.
9.Vollert, Jan et al. “Stratifying patients with peripheral neuropathic pain based on sensory profiles: algorithm and sample size recommendations.” Pain vol. 158,8 (2017): 1446-1455.
10.Jain, Sunil M et al. “Randomized, double-blind, placebo-controlled trial of ISC 17536, an oral inhibitor of transient receptor potential ankyrin 1, in patients with painful diabetic peripheral neuropathy: impact of preserved small nerve fiber function.” Pain vol. 163,6 (2022): e738-e747.






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国