菌肠脑轴,已经不能满足精神疾病的致病机制了,现在还得加上免疫。
2021年10月13日,奥地利科学家在《Cell》杂志上发表了一项重磅研究,揭示了极早产儿大脑损伤与肠道细菌的关联。
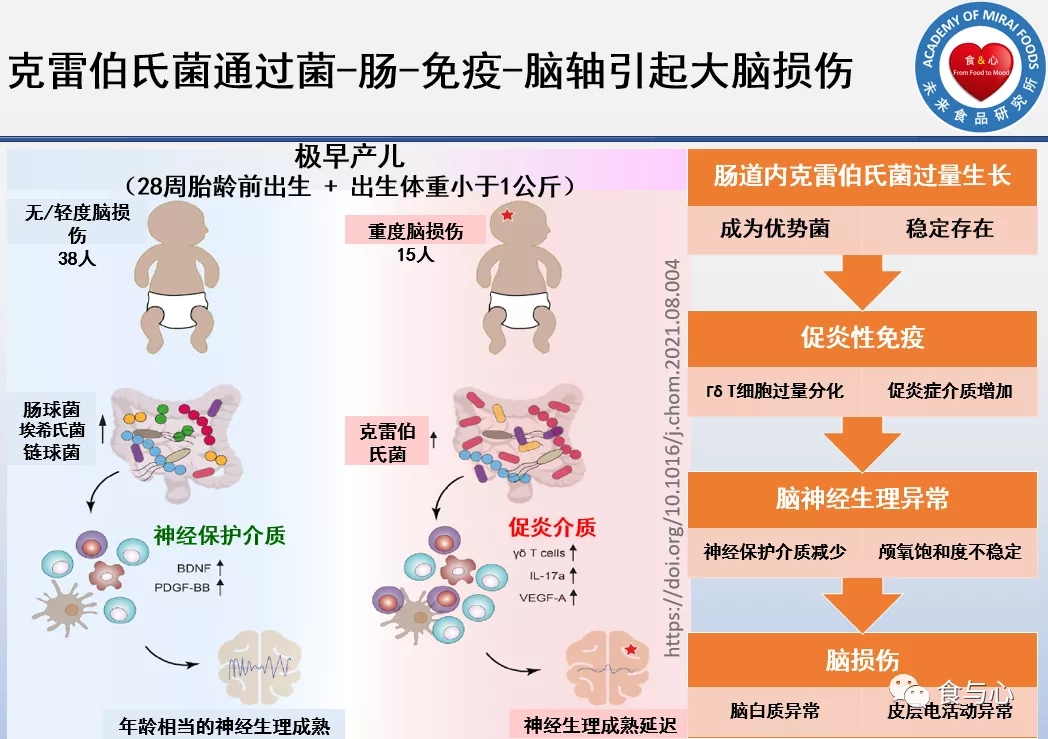
在这项研究中,奥地利医科大学的研究者对60名极早产儿(28周龄前出生)的肠道菌群、免疫指标和神经生理学发育进行了3个多月的追踪,这些极早产儿出生后都进入新生儿监护病房接受标准的特殊护理,直至能够出院正常生活。
 结果发现:
结果发现:
1. 7名极早产儿夭折,53名极早产儿(53名)治疗后达到出院标准,其中38名出现轻度脑损伤,15名及出现重度脑损伤。
2. 在出现脑损伤之前,极早产儿已经表现明显异常的神经生理特征,皮层神经电活动表现出受抑制状态,颅氧饱和度明显不稳定。
3. 极早产儿出生后高水平的VEGF-A和IL-17a相关促炎介质诱发的促炎T细胞分化(主要是γδ T细胞),及随后对神经保护介质(BDNF和PDGF-BB)抑制可能是脑损伤的主要原因。
4. 产后极早产儿肠道菌群数量不断增加,在4-6周时接近顶峰此后趋于平缓。
早产儿的肠道菌群发育中,最引人注意的是克雷伯氏菌。严重脑损伤的极早产儿出生后克雷伯氏菌含量并不高,但产后四周时就增加了1.7倍(以高毒性肺炎克雷伯氏菌为主),随后可形成以克雷伯氏菌主导的稳定菌群;特别是肺炎克雷伯氏菌含量与脑损伤严重程度显著相关。
这种克雷伯氏菌主导,富含韦荣球菌和双歧杆菌的稳定菌群类型与脑损伤密切相关。
5. 出生后早产儿的肠道从局部缺氧逐渐过渡到基本缺氧,随着厌氧菌逐渐占据主导地位,在无氧代谢中发挥关键作用的短链脂肪酸含量不断增加,在出生后50天左右达到顶峰。
在产后一个月时,甲酸盐含量最高,随后丙酸和丁酸盐含量不断增加,这种变化与严格厌氧菌(如梭菌和韦荣球菌)的增加趋势一致。
但是这种过渡过快反而有害,丁酸的过早增加与脑损伤有关。
6. 对于菌群、代谢、临床、免疫和神经生理数据的整合分析显示:严重脑损伤极早产儿的促炎症T细胞分化可由早期的IL-17a和VEGF-A等促炎介质含量增加驱动,促炎的γδ T细胞数量增加和这些促炎介质水平增加与克雷伯氏菌含量密切相关。
 最好,再介绍一下克雷伯氏菌吧,在最肠道菌群检测是很常见,这是一种在自然界中分布广泛,经常在土壤、水、食物以及动物呼吸道和肠道中出现,在生物分类中属于变形菌门、肠杆菌科、克雷伯氏菌属,与大肠杆菌和志贺氏菌为同一科的亲戚。肺炎克雷伯氏菌无疑是这一菌属中最有名的菌,致病性最强,可引起肺、支气管、泌尿道、脑等器官感染以及创伤感染等,是最常见的院内感染菌和超级耐药菌之一。
最好,再介绍一下克雷伯氏菌吧,在最肠道菌群检测是很常见,这是一种在自然界中分布广泛,经常在土壤、水、食物以及动物呼吸道和肠道中出现,在生物分类中属于变形菌门、肠杆菌科、克雷伯氏菌属,与大肠杆菌和志贺氏菌为同一科的亲戚。肺炎克雷伯氏菌无疑是这一菌属中最有名的菌,致病性最强,可引起肺、支气管、泌尿道、脑等器官感染以及创伤感染等,是最常见的院内感染菌和超级耐药菌之一。
早产的孩子们,需要注意了!




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国