用于治疗三阴性乳腺癌的创新药“拓达维”获批在国内上市,是全球首个且唯一获批的靶向Trop-2的ADC药物。三阴性乳腺癌“棘手”在哪?这类药物为何被称为“生物导弹”?
撰文/记者 宋梦 编辑/刘昭
新媒体编辑/李云凤
根据6月10日国家药监局(NMPA)官网的最新公示,注射用戈沙妥珠单抗获批上市,用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
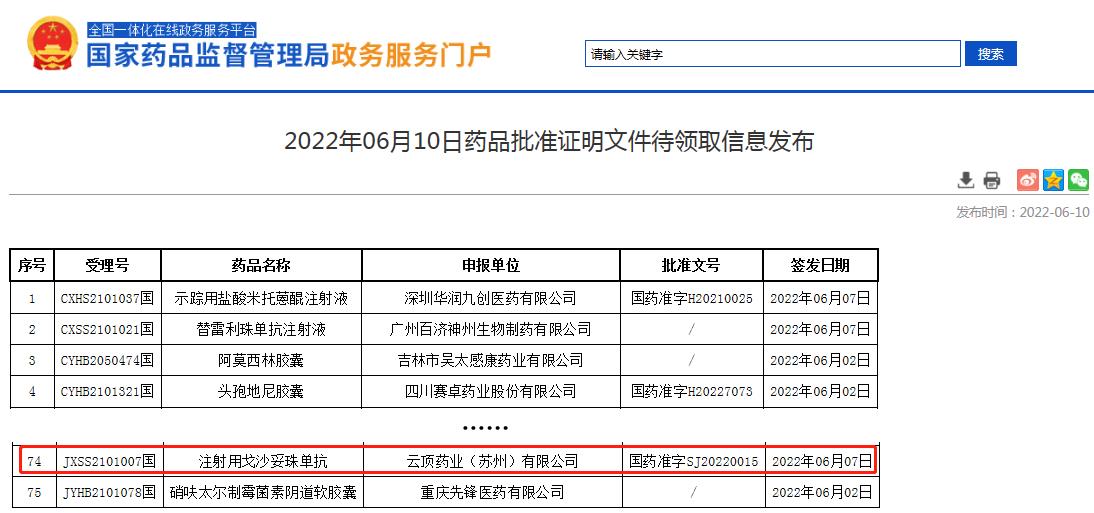
(截图来源:国家药品监督管理局网站)
戈沙妥珠单抗(拓达维)是云顶新耀获准在中国上市的首款创新药品,也是全球首个且唯一获批的靶向Trop-2的ADC药物(即抗体药物偶联物),国家药监局于2021年5月接受其生物制品上市许可申请并授予优先审评。拓达维预计将在今年第四季度正式商业化上市。
最难治的乳腺癌
根据世界卫生组织国际癌症研究机构(IARC)2021年2月发布的全球最新癌症负担数据,2020年全球乳腺癌新发病例高达226万例,已经超过肺癌的220万例。乳腺癌这个主要侵害人群仅为女性的癌症,从新发病例来看已经成为“全球第一大癌”。在国务院印发的《中国妇女发展纲要(2021-2030年)》中,将乳腺癌防治意识明显提高、综合防治能力不断增强作为妇女健康领域的主要目标之一。
在乳腺癌的众多分型中,三阴型乳腺癌生存率低、相对预后较差。不过,近些年一种被称为“生物导弹”的ADC药物为三阴性乳腺癌患者带来新的希望。
深耕乳腺癌领域多年的北京大学人民医院乳腺中心主任、教授王殊,在日常工作中每天都会接触很多罹患乳腺癌的女性。“很多来门诊的女性,在得知确诊结果后,第一反应都是问是不是三阴性乳腺癌。这说明她们有过了解,并且很害怕三阴性乳腺癌。”在2021年10月由北京科技记者编辑协会主办的“科学之声:乳腺癌防治与药物科技创新”活动现场,王殊讲道。
病理报告显示雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达均为阴性的乳腺癌即为三阴性乳腺癌。此型乳腺癌具有发病年轻、复发率高、侵袭性高三大特征,是乳腺癌中最难啃的“硬骨头”。三阴性乳腺癌约占所有乳腺癌类型的10%-20.8%,中国2020年约有41万乳腺癌新发病例,据此比例估算,新发三阴性乳腺癌患者数约为4万-8万。
针对乳腺癌的治疗,早先只有一种比较直接的方式,即手术切除。而现在有更多的内科治疗方式,如化疗、靶向治疗、免疫治疗、内分泌治疗。不过,由于三阴性乳腺癌雌激素受体(ER)、孕激素受体(PR)阴性,限制了内分泌治疗效果;人表皮生长因子受体 2(HER2)阴性,靶向治疗受限,所以目前唯一的系统治疗手段只有化疗。
对于三阴性乳腺癌在免疫及靶向药物的探索仍在进行,目前临床研究比较成功的有两个方向,即PARP抑制剂和免疫抑制剂。其中,PARP抑制剂已被用于BRCA基因(作用于DNA重组修复)突变的患者。但三阴性乳腺癌中大概只有10%的患者有该基因突变,受众相对较少。
另一个方向的免疫疗法,开创了颠覆治疗乳腺癌理念的先河,具有通过自身免疫抑制肿瘤的理论依据,且在国际上已获批其用于三阴性乳腺癌。但由于国内临床试验尚在进行中,所以国内患者可能还没有用到此药。
近些年,一种被称为“生物导弹”的ADC药物能够精准强效杀伤肿瘤,给三阴性乳腺癌患者带来了新的曙光。
“生物导弹”的特殊之处
ADC药物,即抗体药物偶联物( antibody-drug conjugate),是一类通过特定的连接子将靶标特异性的单克隆抗体与高杀伤性的细胞毒性药物偶联起来的靶向生物药剂,以单抗为载体将小分子细胞毒性药物以靶向方式高效地运输至目标肿瘤细胞中。
从整个构成来讲,ADC药物首先要有抗体的部分,这是用来识别敌人的,就是所谓识别抗原。第二部分就是细胞毒性药品。第三部分是将上述二者连接起来的连接子。
“可以通俗地理解为ADC类药物对于肿瘤细胞来说就像是带着毒药的箭。其中,单克隆抗体就是单纯的箭体,细胞毒性药物就像箭头上涂抹的毒药,而连接子就像把毒药固定到箭头上的粘合剂。” 同样深耕乳腺癌领域多年的解放军总医院肿瘤医学部主任医师、教授王涛介绍道。
相比较而言,传统化疗药物对待包括癌细胞内的所有细胞“宁愿错杀一千,绝不放过一个”,效果则是“一损俱损”;而ADC药物之所以号称“生物导弹”,其特殊之处在于直击“贼巢”,直接捕捉癌细胞并发挥药效。
王涛教授补充道,由于ADC 药物在保留小分子细胞毒性药物肿瘤杀伤特性的同时,有效地降低了其脱靶带来的毒副作用,近年来一直是肿瘤精准治疗领域的热门研究方向之一。
狙击乳腺癌的3枚“生物导弹”
早在百年之前,著名的免疫学家Paul Ehrlich就提出了通过“Magic Bullet”将毒性药物靶向递送至微生物或肿瘤细胞的概念。虽然ADC类药物已经有近100年的研发历程,但直至最近十几年,才行驶在了蓬勃发展的高速轨道上。实际上,将两种药物成分组合在一起,在研发及工艺上是非常难的。
“ADC药物中的连接子也特别重要。对于连接子来说,既不能太松也不能太紧,因为太松的话,还没到达待攻打的癌细胞时就脱落了,这样副作用就显现出来了;太紧的话,到了要攻打的癌细胞时,可能进入癌细胞了细胞毒性药物却释放不出来,那么疗效就无法显现出来。”王涛教授感叹道。
据王涛教授介绍,目前全球有 691种ADC类药物,已上市的仅有12种。不过正在研发进程中的非常多,约有245 种新ADC候选药物处于研发阶段,其中15% 处于临床 II/III 期研究。
对于乳腺癌来讲,在全球目前上市的12种ADC药物里面,其中有3种ADC药物都是用于治疗乳腺癌的。这对于乳腺癌患者和医生来说都是一个福音。
这3种ADC药物中,恩美曲妥珠单抗(T-DM1)是第一代ADC药物,2011年在国际上批准上市。第二种DS-8201,是针对HER2阳性的晚期乳腺癌的药物。它和T-DM1作用的人群是一样的,但在药物的研发上,它已经到了第二代和第三代。
第三种是戈沙妥珠单抗,和T-DM1和DS-8201不同之处在于,它针对的抗原不一样。HER2阳性的乳腺癌,在乳腺癌中占到20%到30%的比例;而戈沙妥珠单抗针对的是Trop2的抗原,Trop2在乳腺癌中表达阳性的病人会更多一些。从未来的角度上看,戈沙妥珠单抗不单单对三阴性乳腺癌有效,对于激素依赖性的乳腺癌也会有一定效果,因为激素依赖性的乳腺癌也有Trop2的表达,这方面的研究目前正在进行中。
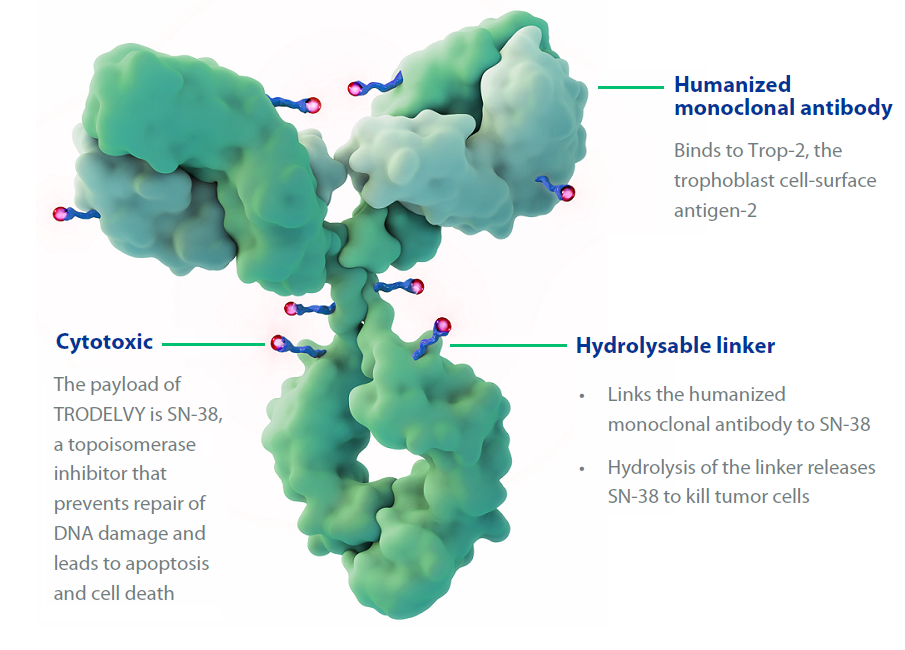
△戈沙妥组单抗示意图(图片来源/ www.trodelvy.com)
新药研发有无限空间
“对于ADC这类创新药物来讲,第一研发比较难,第二仿制起来也比较难。这样的药并不容易仿制,所以原创性的ADC类药物对于病人来讲,或者对于整个药物发展来讲是非常重要的。”王涛教授讲解道。
多年致力于ADC药物研发的云顶新耀肿瘤/免疫领域首席医学官时阳也说到,整个ADC药物的合成中药物的构建有很多的配比,而且还要使得抗体、细胞毒性药物和连接子组合在一起,并且起到关键的作用才行。这也是为什么创造一种ADC药物要横跨40年左右的时间,而且这还是在经历了很多次失败之后。
同时,药物研发的每个环节都是至关重要的,因为每个环节的数据都来自不断地探索,而且药物能在临床上发挥多大的作用,都需要一系列的测试和验证。
“从企业来讲,以临床需求为出发点,能够发挥我们的研发优势,帮助医生寻找到能够治疗或者是延缓病人生存的新的选择,把真正创新的药物从国外引进来,避免卡脖子现象。”时阳介绍。
目前在世界范围内,还有非常多的ADC类药物正在研发中。在整个ADC药物的研发设计思路上,除了针对细胞表面特定抗原的抗体携带化学药品以外,还有很多的方式,包括抗体和偶联物的结合、未来抗体和免疫抑制剂的联合等,这些都是未来ADC类药物发展的方向。ADC类药物从它的合成上来讲,有无限的空间,能够治疗的瘤种也不仅仅是乳腺癌。
曾三次患癌仍始终乐观生活的中国抗癌协会康复会会长史安利教授不禁感慨道:“在我39岁第一次患乳腺癌的时候也曾感到恐慌不安,而70岁又一次患癌,且是三阴性乳腺癌的时候,我却没有太多的恐慌。因为随着医学技术和科技的不断进步,目前已经有很多的措施和药物来治疗此病,再加上早诊断、早治疗,早期乳腺癌也是能够治愈的。”
王涛教授表示,合适的治疗药物,就像医生阻挡疾病侵袭患者的武器。在以前没有治疗药物的时候,医生则是巧妇难为无米之炊,而如今研发能力的提高,以及国家药品审评部门的有力举措,都使得药物的推陈出新较以前快了很多。
另外,王殊教授也强调:“三阴性乳腺癌并不是不可治,即使没有所有的靶向药物,还有化疗可以优化。现在有了更多的靶向药物、免疫药物,还有了ADC药物,我相信在三阴性乳腺癌治疗的路上,没有最好,只有更好。”■
||||
(本文内容整理自2021年10月12日“科学之声:乳腺癌防治与药物科技创新”活动专家演讲)

出品:科普中央厨房
监制:北京科技报 | 北科传媒
欢迎分享到朋友圈
未经授权谢绝转载






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国