我听见赞誉来自人海,我排着队拿着诺奖的号码牌科普中国-科普融合创作与传播 2020-10-04 作者:张昊(大阪大学) |
又是一年诺奖季,这几天收到最多的问题就是,“你认为今年谁有可能拿诺奖?”
其实这问题我和朋友们也经常讨论,虽然各有见解,但有一件事情大家的意见非常一致,那就是对于生理学奖来说,有大把的成果在等着拿诺奖。
今天,我们就重点整理下与癌症基因直接相关的诺奖级研究,看看都有哪些重磅成果,正拿着诺奖号码牌在排队。
为什么重点关注癌症基因相关的成果?
进入二十世纪以来,人类凭借医学科技先后战胜了绝大多数的传染病和外伤,但在平均寿命不断延长的同时,癌症也逐渐成为了困扰人类的终极梦魇。科学家们一直在思考癌症的发病机理,即到底是什么因素造成了肿瘤的生长和发育。经过近百年的艰苦探索,人类终于明确癌细胞的产生是基因变异的结果。同时,对癌症的预防和治疗也全面进入了以癌症基因作为依据和核心的时代。
这一成就的取得当然不是几个人的功劳,但在人类抗癌的征途之上,仍然诞生了数个里程碑式的科学成果。它们中的一部分已经斩获了诺贝尔奖,还有一部分则随时有获奖的可能。

(图片来源:Freepik.com)
黎明前的曙光——致癌病毒的发现
19世纪末,当时的癌症学家们已经发现不少肿瘤具有传染性,当将实验动物身上的肿瘤组织移植到其它健康同类时,癌症也会被随之诱发。1909年起,洛克菲勒医学研究所的裴顿·劳斯开始深入地探索这一现象。他的做法并非是直接移植组织,而是移植破碎并过滤后的肿瘤萃取物。他惊奇地发现即便经过重重过滤,萃取物仍然能够让健康的鸡发生癌变。1911年,劳斯分离出了萃取物中可能引发癌症的病毒——劳斯肉瘤病毒(RSV),癌症研究史早期的第一个重大成果就此诞生。
起初,由于人类对病毒的研究仍然处在早期阶段,他的成果在学术界并未引发重视,直到1966年,劳斯才以87岁高龄获得了诺贝尔生理学或医学奖。在劳斯的成就逐步得到公认的同时,人类陆续发现了一系列可能引发肿瘤的病毒,很多人开始相信癌症的病毒致病说。这种说法认为所有的癌症皆由病毒引起,任何肿瘤都能找到其对应的病毒。
现在来看,这种说法是错误的,病毒确实可以导致癌症,但并非所有的病毒都有致癌性,也并非所有的肿瘤都由病毒引发。可能引起肿瘤的病毒到底有什么特殊之处?对这一问题的深入钻研又直接导致了接下来的第二个重大成果。
震惊世人的大发现——原癌基因
1974年,加州大学旧金山分校的约翰·毕晓普和哈罗德·瓦慕斯在对RSV病毒的致癌机理继续进行深入研究时,遭遇了预料之外的发现。彼时人们已经知道RSV病毒的结构非常简单,基因组只有约9000个碱基,而且其中一段名为src基因的序列与病毒感染细胞并诱发癌变关系密切。失去了src基因的RSV病毒同样能够正常感染宿主细胞并进行扩增繁殖,但它们无法将正常细胞转化为癌细胞,致癌能力大大下降。
瓦慕斯和毕晓普采用了当时最先进的分析技术,这是一种能够特异性识别src基因的DNA探针,而且它还能测出各种细胞中src基因的含量。根据设想,他们二人本以为只能从受到RSV病毒感染的细胞中测出src基因,结果却发现正常细胞中也有src基因的存在。此后的实验证明,src基因广泛地存在于几乎所有高等动物的基因组中,它们并非是RSV病毒所特有。
那么,区区RSV病毒,凭什么能跟高等动物们共有src基因呢?科学家们认为,RSV病毒在进化初期并不携带src基因。在感染动物细胞的同时,偶然间将宿主细胞中的src基因纳入了自己的基因组。由于癌变后的细胞内部及肿瘤微环境对病毒来说简直是天堂,加入src基因的病毒更容易诱发肿瘤,具有进化优势,因此src基因就被固定在了RSV病毒的基因组中。
随后,对一系列致癌病毒的研究发现,它们的致癌机理大致分成两种。第一,自带已经变异的关键致癌基因(如RSV携带的src基因),感染人体后将自身基因组整合到人体基因组的过程中同时导入该基因。第二,虽然没有携带关键的致癌基因,但当它们恰好整合到人体基因组的某些特殊位置时,细胞就会发生癌变。这些位置附近的基因本来完好无损,但病毒基因的突然插入,将会诱发它们的变异。无论属于哪种情况,细胞最后都可能走上癌变道路。
这种早就存在于人体,平时执行正常生理功能,但变异后却能产生致癌作用的人体基因,就叫原癌基因,变异后具备致癌能力的原癌基因又被称为致癌基因。1989年,发现人类第一个原癌基因的毕晓普和瓦慕斯获得了诺贝尔奖。原癌基因的发现标志着人类真正开始认识到基因与癌症间的关联,人类也自此将癌症发病机理研究的重点转移到了癌症相关基因上。
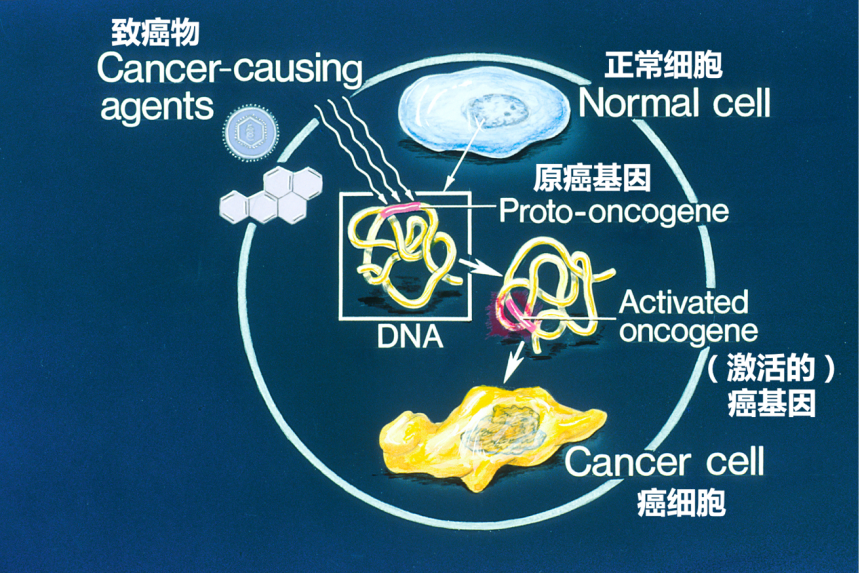
致癌物作用下原癌基因转变为癌基因导致细胞癌变的示意图(图片来源:维基百科“原癌基因”)
解密关键的致癌基因和抑癌基因
经过数十年的研究,人类已经确认细胞的某些基因变异是造成细胞癌变,最终形成肿瘤的罪魁祸首,一系列与癌症相关的基因,也先后得到了定位。这些基因大致分为两种类别,一种是致癌基因,一种叫抑癌基因。
前者在变异前一般参与细胞的再生、分化等过程,一旦发生变异,细胞就会发生失控生长。在变异基因的指导下,大量异常蛋白质被合成,最终导致癌变。
后者在变异前一般与细胞的凋亡、自噬等过程有关,一旦发生变异,细胞生长同样会发生失控。基因变异导致细胞正常的死亡机制紊乱,出现大量的异常蛋白质,最终导致癌变。
打个比方,前者好比是油门卡死、后者好比是刹车失控,无论哪个都可能造成车毁人亡的悲剧。
无论是致癌基因还是抑癌基因,在发生变异之前,都能行使正常功能。当细胞受到各种物理(比如摩擦)、化学(比如致癌物质)乃至生物刺激(比如致癌病毒),这些基因就可能发生突变,从而诱发癌细胞的生成。
原癌基因于1989年获得诺贝尔奖时,人类已经定位了数十个致癌基因,但第一个抑癌基因Rb-1其实在1984年才被分离出来。在诺奖委员会官方对原癌基因提供的成果解说中,已经提到了人体中存在一系列可以调控(regulate)细胞生长的基因,调控自然可能包含促进和抑制两个部分。

毕晓普和瓦慕斯以及1989年诺奖官方科普,注意其中的“regulated”(图片来源:诺贝尔奖官网)
无论这一说法是有心为之还是纯属巧合,抑癌基因再次单独获得诺贝尔奖的可能性已经大大减小了。但是,癌症基因的相关深入研究,特别是对某些特定的致癌和抑癌基因的发现和解析,却为不少癌症药物的开发提供了理论依据,也实实在在地拯救了无数的生命。
例如,经典的抑癌基因BRCA1和BRCA2,分别位于人类第17号染色体和13号染色体,两者同时发生变异后,乳腺癌的终生发病率可以提高到80%以上。从1974年开始,加州大学伯克利分校的玛莉-克莱尔·金一直在尝试寻找乳腺癌患者身上的家族遗传标记。当时,癌基因相关研究仍然处在萌芽阶段,病毒致癌说仍然占据主流,大部分科学家都认为即便基因和癌症有关系,癌症也不可能仅仅由一个基因变异引发,而应该至少是多个基因和环境作用下的共同结果。这样的学术氛围也让一直在苦苦追寻真相的金感到茫然,她时常怀疑自己是否选择了错误的研究方向。
80年代中期开始,金的研究逐渐取得了进展,通过对大量乳癌患者和她们家族病史的筛查,金建立了乳癌的遗传疫学模型,并预言了存在一个可能引发乳腺癌的关键基因。随后,金的团队筛选了超过170种可疑基因,终于在1990年发表研究结论称,人类17号染色体上的某个关键基因,是造成乳腺癌和卵巢癌风险增加的元凶。1991年,金将这一基因正式命名为BRCA1。1994年,乘胜追击的金研究团队利用类似的研究方法,发现了BRCA2基因。
进一步的研究表明,BRCA1和BRCA2基因主要负责清理异常细胞和衰老细胞,一旦发生变异,这种清理功能就将受到影响,细胞癌变可能性就会增加。而在很多人群,如纽约的阿什肯纳兹犹太人女性后裔中,BRCA基因的突变率相当高,这直接导致她们发生家族遗传性乳腺癌的风险达到普通人群的7倍。70岁的正常女性人群中,乳腺癌发病风险约为12%,而阿什肯纳兹犹太人女性后裔则高达80%。
乳腺癌基因的发现,令乳腺癌的预防成为可能,携带突变BRCA基因的女性,可以在患癌风险开始增加的中老年阶段通过切除乳腺来预防致命癌症的发生。知名影星安吉丽娜·朱莉就是BRCA基因突变的携带者,经过基因测试,她的乳腺癌和卵巢癌患病风险分别高达87%和50%。为了避免罹患癌症,朱莉于2013年4月27日接受了乳腺预防切除术。

玛莉-克莱尔·金(左)与安吉丽娜·朱莉(右),来源:维基百科
原癌基因获得诺贝尔奖确实属于实至名归,其后对致癌基因和抑癌基因的解析以及由此促成的靶向药物研发,从原创性角度而言自然不能与原癌基因相比。但癌症是人类有史以来面临的最为复杂、最多样化的疾病,原创性成果之后的重量级次生成果,同样有理由引起诺贝尔奖委员会的关注。对第一个抑癌基因Rb-1的发现起到关键作用的阿尔弗雷德·克努森本应有资格荣获诺奖,但他已于2016年去世,遗憾地失去了获奖机会。
除此之外,发现乳腺癌基因BRCA的玛莉-克莱尔·金,在致癌基因和抑癌基因领域做出了重大贡献的罗伯特·温伯格,都已经荣获了拉斯克奖、邵逸夫奖和沃尔夫奖一类重磅奖项,他们在未来同样有获得诺奖的机会。
破解癌细胞的“传令蛋白质”
癌基因相关研究取得的进展,彻底改变了癌症研究和治疗的面貌。这是因为只有定位了癌基因,才能追查出其所编码的蛋白质(当然有的时候是先发现蛋白质然后再反向解构其对应的癌基因),人们才能通过进一步了解该蛋白质在人体细胞中的生化作用,了解癌细胞是如何兴风作浪的。
研究发现,相当一部分致癌基因与生长信号的传递过程有关。那么,什么是生长信号呢?细胞身处于人体组织内部,其周遭的体液中存在着诸多能够刺激细胞生长的物质,比如激素就是其中的典型例子。这里所谓的细胞生长,并非是单纯的体积变大,而是指细胞在这些物质的作用之下,会制造更多蛋白质,并加速增殖分裂。
由于制造蛋白质需要基因的参与和指导,生长信号需要从细胞膜外一直传递到基因所在的细胞核中,中间经历若干过程。而每一个过程都会有特定的分子进行参与,这些参与生长信号传递的分子大部分也是蛋白质,我们姑且把它们叫做传令蛋白质。正常情况下,细胞不会无限制地接受来自外界的生长信号,传令蛋白质们各司其职,保证传令过程安定平稳。
需要注意的是,其实每一个传令蛋白质都会对应一个用来合成自己的相应基因。一旦这些基因发生问题,例如过表达或者变异等,对应的传令蛋白质就会暴走,擅自假传圣旨,要求细胞核合成不必要的蛋白质或者进一步分裂增殖等。
我们举一个“暴走传令兵”的例子。HER-2是一种很早就被发现和研究的原癌基因,位于人类第17号染色体的长臂。由它控制合成的蛋白质(HER-2,人类表皮生长因子受体2)在细胞膜表面充当“天线”,接纳来自外界的生长信号(人类表皮生长因子)。生长信号一来,HER-2蛋白就将其传入细胞内部。
当HER-2基因发生变异(一般是过量表达)时,细胞膜表面接受生长信号的天线就会比平时多,大量生长信号涌入细胞内部,最终造成细胞恶性生长。对HER-2基因和其对应蛋白质的解析,直接促成了赫赛汀的开发。赫赛汀是一种单克隆抗体,也是人类第一款根据新发现的癌基因研制的靶向抗肿瘤药物。赫赛汀在细胞膜表面起到关闭天线的作用,可以阻断细胞生长信号向肿瘤细胞进一步传递的过程,进而延缓肿瘤的生长。
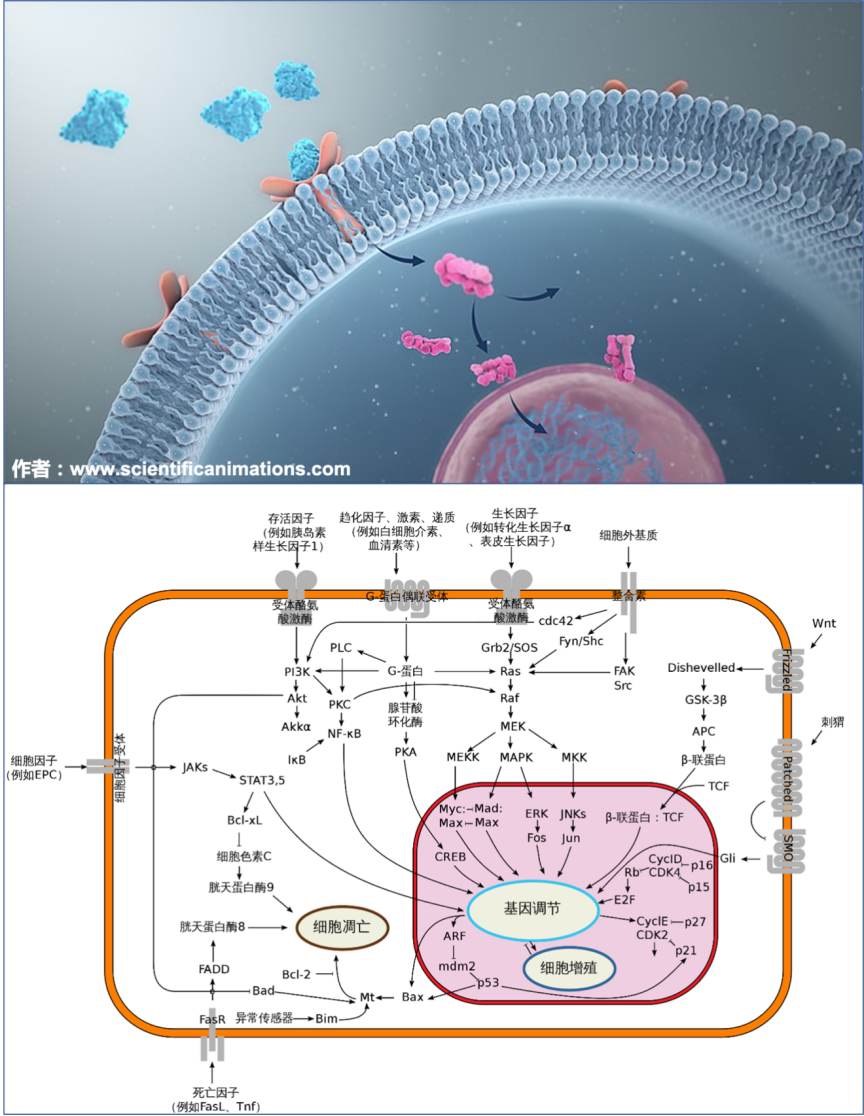
细胞外信号跨越细胞膜传递进细胞内部的示意图(上),人体细胞中常见的信号传导路径(下)(图片来源:维基百科“信号传导”)
与之类似,形形色色的暴走传令兵都有其自身的特殊结构,人类可以根据它们的结构,制造相应的靶向药物,这些药物都有掐断信号传递的功能。在细胞膜外,我们可以使用大分子靶向药物,直接中和生长物质,或者关闭细胞膜上的天线。而在大分子不容易进入的细胞膜内部,我们又可以用小分子靶向药物去阻断信号向下游的传播。
HER-2基因的研究先驱阿克塞尔·乌尔里希同时也是赫赛汀的主要发明人之一,他的另一个主要功绩是小分子抗肿瘤药物舒尼替尼的开发。目前,乌尔里希已经坐拥拉斯克奖和沃尔夫奖,如果能够再获诺奖,将成为少数独揽三大科学大奖的科学家。此外,在生长信号传递机理方面多有建树的安东尼·亨特和安东尼·鲍森也曾得到沃尔夫奖的加持,他们的研究可以理解为是揭开每个传令兵的身份。
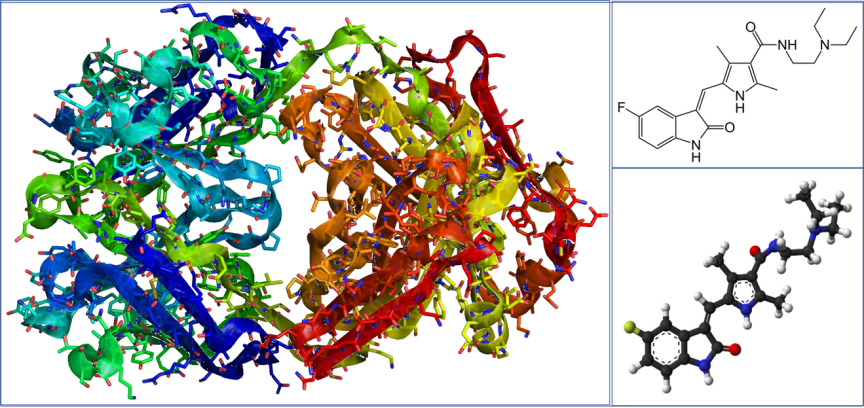
赫赛汀(左)和舒尼替尼(右)的结构示意图,注意分子大小的差异(图片来源:维基百科“赫赛汀”“舒尼替尼”)
染色体重组与“神药”的诞生
我们已经讲过基因变异是细胞癌变的主因,基因具体的变异方式有很多,比较常见的是单个碱基的置换和碱基的缺失。个别基因的加倍,即染色体组中该基因的数目增加也是常见的基因变异形式。很多癌基因就是通过加倍的方式,制造自己的分身,从而达到多表达相关蛋白质的目的。
另外,基因位于染色体上,当染色体出现问题,位于其上的基因当然也会产生变异,很多染色体异常同样会造成癌症。我们现在所熟知的这一现象,在上世纪中叶之前对人类而言仍然是未知领域。人类最早认识到这一点,还要从费城染色体的发现说起。1956年到1960年间,彼得·诺维尔和大卫·亨格福德在对人类白血病进行研究时,发现绝大多数(多达95%)慢性粒细胞性白血病患者的癌细胞中,第22号染色体与常人相比明显更短。
进一步的分析表明,不光是癌细胞,这些患者基因组中的22号染色体确实存在异常,这是人类第一次证明染色体异常和癌症间的强烈关联性。由于诺维尔与亨格福德在美国费城完成这项研究,因此人们将这种发生异常的22号染色体称为费城染色体。至此,费城染色体的故事才刚刚开始。
科学家们知道了费城染色体存在异常,但是这种异常如何发生,尚且不得而知。1973年,芝加哥大学的珍妮特·罗利发现,费城染色体出现的真正原因在于携带者的9号染色体和22号染色体发生了一部分交换(称为染色体易位),交换的结果就是9号染色体变长了一点,而22号染色体则变短了。接下来的问题,就是回答为什么这种易位会造成白血病的发生。
在众多科学家的努力下,真相被逐步揭开。1983年,科学家们又进一步解析了9号和22号染色体易位的后果。易位后,9号染色体上的Abl基因和22号染色体上的BCR基因恰好连接在了一起,拼成了一个原本不存在于人类基因组的BCR-Abl融合基因。这个基因可以编码一种结构特殊的酪氨酸激酶,这正是我们前面提到的一种“暴走传令兵”。接下来的任务就是设法发明阻断药物,让暴走的酪氨酸激酶停止作妖。
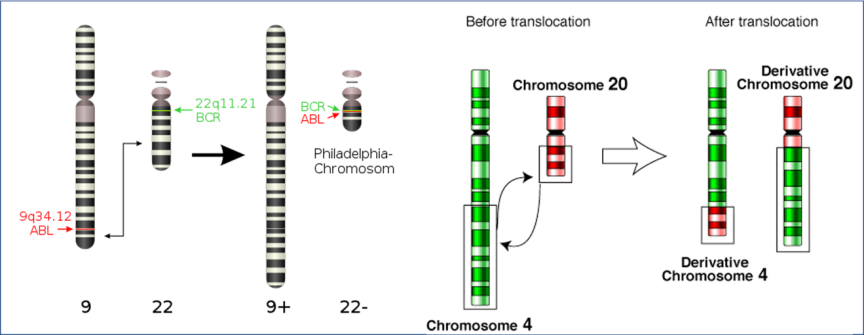
9号/22号染色体易位和4号/20号染色体易位示意图(图片来源:维基百科“染色体易位”)
九十年代初,一直致力于研究酪氨酸激酶抑制剂的以色列科学家亚历山大·莱维斯基,证实某种抑制剂有促使慢性粒细胞性白血病的癌细胞死亡的效果。布莱恩·德鲁克尔和尼古拉斯·莱登在此基础上制备了代号STI571的化合物伊马替尼,它还有个更响亮的名字——“格列卫”。
伊马替尼是人类历史上第一个成功研制的小分子靶向药物,它的出现让曾经的不治之症变成了只需定期服药就能得以控制的慢性疾病,绝大多数慢粒白血病患者都能享有和常人无异的生活与寿命。
现在,人们已经知道,染色体在人体内发生各种异常的概率比原先的想象要高。染色体不仅可能出现某些片段的缺失、重复、倒置,还能在两条染色体间发生插入、易位重组、自成环甚至相互连接,还有可能发生被称为“染色体粉碎”的现象。
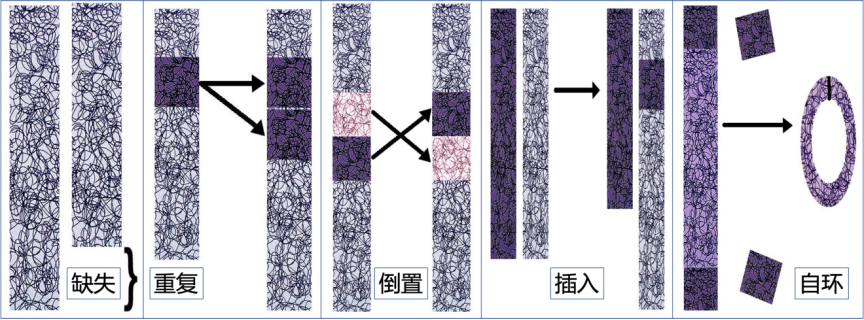
染色体易位以外的各种染色体异常(图片来源:参考文献 10)
染色体粉碎是最初在肿瘤细胞中发现的一种复杂的基因组重排现象。细胞的一条(或几条)染色体在短时间内发生大量的DNA双链断裂,形成小的DNA碎片,之后这些碎片被细胞的DNA修复机制随机地拼接起来,形成新的染色体。
染色体粉碎相当于DNA上基因片段的大洗牌,其对于基因组正常功能的影响可想而知。染色体粉碎会同时影响大量基因,引起基因的扩增、缺失、重排和融合等,从而导致正常细胞向肿瘤细胞的快速转化。
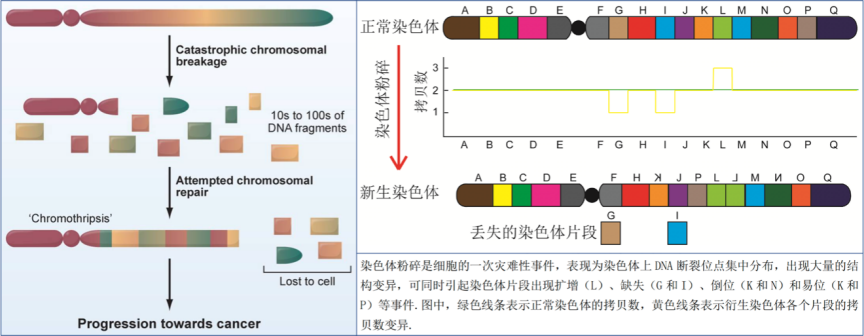
染色体粉碎示意图(左)和粉碎后的异常举例(右)(图片来源:参考文献 9)
从1960年发现费城染色体,到1992年伊马替尼开始临床实验,再到2001年FDA批准格列卫上市,已经过去了40年。从这段历史中,我们可以深切地体会到科学研究的传承和发展,以及取得成功的艰难与不易。发现费城染色体的两位科学家已经离开人世,上面提到名字的其余科学家均得到过沃尔夫奖或拉斯克奖的肯定,他们中的任何人在未来获得诺奖都毫不意外。
问题不光出在基因序列上——DNA甲基化
DNA作为遗传物质,实际上存在于我们体内的每一个体细胞中,而且各种体细胞虽然都有自身的功能,但其实它们携带的DNA序列都是同一套。为什么同一套DNA最后会表达出不一样的细胞?或者说为什么皮肤细胞增殖以后还是皮肤细胞,而不会变成小肠上皮细胞?
同一套遗传物质,在不同体细胞中出现不同表达的现象,说明了遗传物质在进行表达的时候会有所取舍。细胞内的DNA,缠绕在组蛋白周围,我们姑且把DNA称为“细胞饭店”,把根据DNA所能表达的蛋白质称为“菜谱”。
通过上面的叙述,我们可以看出虽然“细胞饭店”准备了一本厚厚的“菜谱”,但是根据“分店”位置和“顾客”类型的不同,“套餐”种类也不一样。那么,不同“分店”决定自己独有“套餐”的机制到底是怎样的?这位“配餐师”,就是DNA甲基化。
DNA长链中,有一些特殊的位置,可以通过添加一个甲基来形成甲基化。也就是说碱基对的序列并没有变化,只不过是在某些位置上添加了一点点小小的“印记”。这种“印记”的权力和作用相当大,哪些基因能够表达,哪些基因需要掩盖,正是由这些“印记”所决定。“印记”的存在与否,是基因能否表达的关键。
而且,细胞分裂的时候,不仅DNA序列,其上存在的甲基“印记”也会同时被复制,这就决定了细胞种类的稳定性,“分店”开的再多,“菜谱”也保持不变。
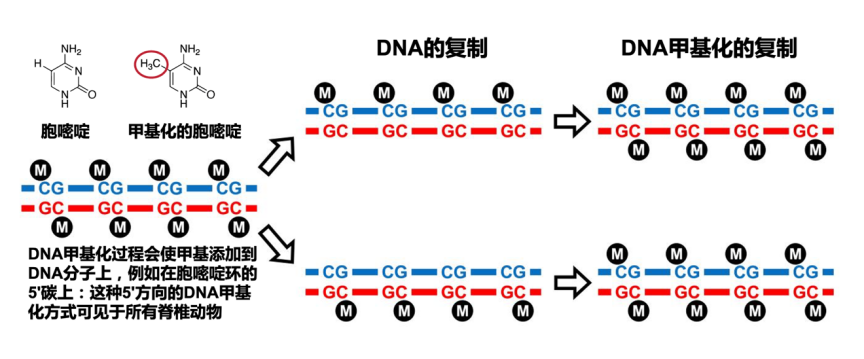
DNA甲基化和DNA甲基化的复制,来源:参考文献 15
九十年代后,科学家们注意到,DNA甲基化异常是抑癌基因失效的重要原因之一。癌细胞中,很多种抑癌基因被打上错误的“标记”,造成抑癌作用无法发挥,进而产生癌变可能。在胃癌等很多种癌症中,DNA甲基化造成的抑癌基因失效,比基因的突然变异和染色体异常发生的几率还要高。
类似DNA甲基化这样,虽然没有发生DNA遗传序列的变化,但是仍然可以表现出不同性状的遗传形式,叫做表观遗传学。DNA甲基化只是表观遗传学中的一种作用方式,其它的形式还包括组蛋白修饰、RNA干扰等等。
在DNA甲基化以及由此致癌的相关研究早期起到关键作用的霍华德·锡达和阿哈龙·拉津,已经获得了沃尔夫奖和盖尔德纳国际奖,但遗憾的是阿哈龙·拉津已于2019年去世。鉴于人类对表观遗传学重要性的认识在逐渐深入,霍华德·锡达在未来获得诺奖的可能性相当大。
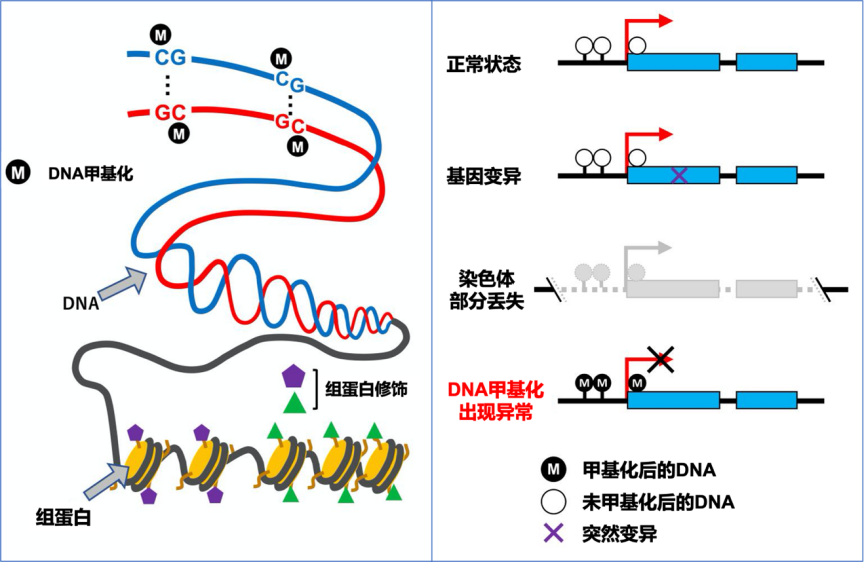
DNA甲基化示意图以及甲基化异常造成的基因失效(图片来源:参考文献 15)
癌症作为困扰人类的重大顽疾,每年可以造成将近2000万新增病例和将近1000万死亡病例,并且给患者本身、家人乃至全社会带来巨大的痛苦。今天介绍的这几项与癌基因直接相关的研究,均是人类抗癌斗争史上的高光片段。它们的出现,让人类对抗癌症的手段和技术水平发生了根本性的飞跃。
期待这些向未知进军,艰苦求索的科学家们,能够最终获得诺奖殊荣。
参考文献:
1.細胞ががん化する仕組み
https://ganjoho.jp/public/dia_tre/knowledge/cancerous_change.html
2.涨知识丨一文总结100多年来与癌症相关的诺贝尔奖!-MedSci.cn
https://www.medsci.cn/article/show_article.do?id=fea118089229
3.从肿瘤病毒到原癌基因:原癌基因的发现简史 - 知乎
https://zhuanlan.zhihu.com/p/98630571
4.一只鸡背后的惊天秘密 —— 原癌基因现形记
https://baike.baidu.com/tashuo/browse/content?id=f39dc6c736992f407976791f&lemmaId=5171076&fromLemmaModule=pcBottom
5.现身说法:怎么才能得诺贝尔奖?|科学春秋
http://zhishifenzi.blog.caixin.com/archives/169483
6.がん抑制遺伝子とがん遺伝子とは - 医療総合QLife
https://www.qlife.jp/dictionary/item/i_301670000/
7.遗传悲剧:抑癌基因的发现
http://story.kedo.gov.cn/c/2019-09-18/984625.shtml
8.腫瘍生物学とがん治療
http://archive.jsco.or.jp/data/jp/detail_images/53/ESM-1.pdf
9.染色体粉碎--基因组灾难性事件产物
http://www.pibb.ac.cn/html/2017/1/20160180.htm
10.染色体变异
http://www.eurogentest.org/fileadmin/templates/eugt/leaflets/pdf/chinese/chromosome_changes.pdf
11.Massive Genomic Rearrangement Acquired in a Single Catastrophic Event during Cancer Development
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3065307/
12.格列卫诞生记:难以复制的抗癌奇迹
https://m.huxiu.com/article/251365.html
13.我不是药神》里的格列宁,究竟是不是“神药”?| 果壳 科技有意思
https://www.guokr.com/article/443063
14.Antioncogenes and human cancer
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC47892/
15.エピジェネティクスとは? | 国立がん研究センター 研究所
https://www.ncc.go.jp/jp/ri/division/epigenomics/project/010/010/20200520100311.html
责任编辑:科普云
 科普中国APP
科普中国APP
 科普中国微信
科普中国微信
 科普中国微博
科普中国微博

最新文章
-
为何太阳系所有行星都在同一平面上旋转?
新浪科技 2021-09-29
-
我国学者揭示早期宇宙星际间重元素起源之谜
中国科学报 2021-09-29
-
比“胖五”更能扛!我国新一代载人运载火箭要来了
科技日报 2021-09-29
-
5G演进已开始,6G研究正进行
光明日报 2021-09-28
-
“早期暗能量”或让宇宙年轻10亿岁
科技日报 2021-09-28
-
5G、大数据、人工智能,看看现代交通的创新元素
新华网 2021-09-28