离子缔合科普中国-科学百科 2018-06-19 作者:王宁 |
离子缔合(ionic association),两个异号电荷离子相互接近到某一临界距离形成离子对的过程。离子对为两个溶剂化异号电荷离子以库仑力相互吸引,静电能大于热运动能,在运动过程中,离子对是一个实体,并具有足够的稳定性。离子缔合概念是1926年N.J.布耶鲁姆提出的,他认为在溶液中凡是异号电荷离子间静电吸引能超过2kT,即可形成离子对。根据库仑定律,离子间静电作用势能V为:V=|ZiZj|e2/Dq(1)式中q为离子间临界距离;D为溶剂介质常数;e为元电荷;ZiZj为i、j离子的电价。
离子缔合概念
Debye-Hnckel的活度系数极限公式只能用在高度稀释的溶液中,浓度稍高,就会出现较大偏差。偏差可以有两类:一类是实验数据对极限公式有正的偏差,我们用(1+κa)除以带有I 1/2的项来解释这类偏差;另一类是负偏差.离子互吸理论无法解释,Bjerrum提出离子缔合的概念可解决这个困难。离子缔合理论与Debye-Huckel 理论相比是另一种物理模型,它把电解质溶液的活度系数理论从低浓度推进到高浓度。1
Bjerrum提出的离子缔合理论认为,强电解质在水溶液中虽可完全以离子状态存在.但在某一定浓度下每个离子并非都能独立运动,即虽然完全离子化但并非完全解离。这是由于溶液中不同电荷的离子相互靠近到某一临界距离时,离子间的静电作用能量可能大于离子热运动的能量,因而阴、阳离子可能缔合成一个新单元,作为一个整体在溶液中运动。我们把这种作用叫作离子缔合;由两个离子缔合而成的新单元称为离子对,三个离子可缔合成三离子物,更多离子可缔合成离子簇团,等等。离子在溶液中不停地运动,单个的离子物(离子对、三离子物、离子簇团……)存在的时间可能很短,在溶液中每一瞬间都有许多离子缔合物分解,同时又有许多离子缔合物生成,所以从统计的观点来看,溶液中总是有一定数量的离子缔合物存在。阳离子与阴离子间的相互作用为
M+ +X- —→MX0
用缔合常数表示为:
KA=aMX0/aM+ ·aM- 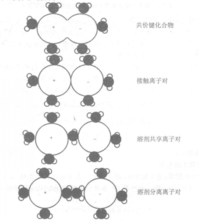
式中:a(i)是组分i的活度,离子对可以归纳为四类,如图所示。
(1)配合物一离子通过共价键结合;
(2)接触离子对一离子是接触的并通过静电力相互作用;
(3)溶剂分隔的离子对一离子对通过静电作用联系在一起,中间被一个溶剂分子(水分子)分开。
(4)溶剂分隔的离子对一离子对通过静电作用联系在一起,中间被超过一个的溶剂分子(水分子)分开。
Bjerrum的离子缔合理论
假设在体积为V的溶液中,含有i和j两种相反电荷的离子,如图所示。令一个j离子为中心离子,距中心离子,一处有一厚度为dr的圆球形壳层。在这壳层中,i离子存在的几率W(r)与下述因数成正比:①溶液中i离子的数目Ni;②壳层具有的体积4πr2dr对溶液体积V的比率,即(4πr2dr/V);③Bollzmann因数e-zie0φ/kT(φ是在r距离处的壳层表面的电位)。因此,可以得出
W(r) =Ni4πrdr/V·(e-zie0φ/kT)
式中:φ由两项组成,即中心离子j所引起的在r距离上的电位和离子雾所引起的在r距离上的电位。
Bjerrum假设:当r很小时,离子雾所引起的电位可以忽略,φ电位就是中心离子的电位zje0/Dr。nj=Nj/V为单位体积(1 mL)内i离子的数目,可以得出
W(r) =4πnir2dr·(e-zizje02g//DkTr)
由于上述公式右边有两个因数是随着r的增加而变化的,一个是指数项e-zizje02g//DkTr,由于i和j有相反的电荷,此指数项随r的增加而下降;另一个因数是圆球形壳层的体积4πr2dr,显然随r的增加而上升。当r接近a时,D很小,zizje02/Dr》kT,W(r)值很大。因a是r的最小值,r=a时W(r)有最大值。当r增加时,指数项下降而壳层体积上升。在r值小时下降值远超过上升值,因而总的情况是W(r)随r的增加而急速下降。当r中q值时,下降值等于上升值,W(r)达到一个最低值。此后,W(r)随 r的增加而上升,并发散到无限值。
离子缔合作用
铵盐等大的萃取剂阳离子可与水相中的金属配合阴离子缔合而萃入有机相,例如
FeCl3/H2O一HCL/C2H5OC2H5体系
萃合物是离子对:[C2H5—O+H—C2H5]·[FeCl4-]
又如,SbCl5/H2O—HCl/罗丹明B—C6H6体系,萃合物是离子对:
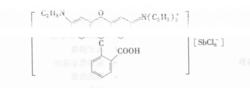
大离子缔合体系有利于萃取是由于:
(1)离子势Z2/R大大降低了,即在大离子外缘球面上电荷密度很小,故水化很弱。
(2)离子很大,根据空腔作用的规律,有利于萃取。
(3)大离子的外缘基团是碳化合物,根据相似性原理,易溶于有机相而不易溶于水相。
(4)大离子的外缘基团把亲水性基团包容在内,例如(C2H5—O+H—C2H5)。2
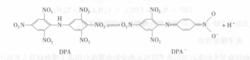
在以上基团中,外缘乙基把亲水性的O—H基团包容起来,因而阻碍了后者的水化。如果金属离子不能生成配阴离子,那么可以用一个大的有机阴离子去缔合金属阳离子,例如双(三硝基苯)胺(DPA)在硝基苯中的溶液可以有效地萃取Cs+,Cs+/NaOH 0.1mol/L/DPA(0.01mol/L)-硝基苯,分配比D=200。
在这个体系中水相的碱性是很重要的,如在HCl(1mol/L)介质中,D只有0.01,所以1mol/L HCl可以用来反萃取,这是因为碱性有利于DPA电离为DPA-及H+:
以上扼要地在理论上分析了影响萃取率的各种因素。
离子缔合体系
最简单的离子缔合体系包含体积大的阳离子和阴离子,其大小和结构要使之不具有基本的水合层。相对简单的化学计量平衡就足以描述这些离子缔合体系,在水相中有离子对的解离,而在有机相中有缔合。一个例子是用含有氯化四苯基钟作为离子对的有机溶剂从水相中以高铼酸盐(Ⅶ)的形式萃取铼(在相互缔合的阳离子和阴离子之间的逗号表示离子对的形成)。
[(C6H5)4As+,Cl-]org ←→ [C6H5)4As+,ReO4-] +Cl-
对其他大体积阴离子也可进行类似的萃取,如TcO4-,MnO4-,ClO4-和ClO4-。一般的规律(有某些例外)是带单电荷的大体积阳离子容易与大体积单电荷阴离子形成可萃取的离子缔合物。
氯化四苯基镇的苯取行为在定性和定量方面均与其钟类似物相同。
因为多价阴离子更容易形成水合物而不太容易萃取,故容易使上述阴离子与铬酸盐(Ⅵ)(2-)、钼酸盐(Ⅵ)(2-)和钨酸盐(Ⅵ)(2-)分离。从酸性溶液中萃取铬(Ⅳ)无疑是因为酸性介质中有HCrO4-或HC2O7-的存在,但在二价阴离子占主导地位的碱性溶液中则几乎不能萃取。
如果金属离子可与卤素离子络合而形成大体积络合物阴离子,则常常可以与适当的大体积阳离子形成可萃取的离子对。因此,碱性染料若丹明B的阳离子可将下述阴离子萃取到苯中:AuBr4-,AuCI4-,FeCl4-,GaCl4-,TiCl4-和TiBr4-。孔雀绿、甲基紫和其他染料及指示剂可用作萃取剂。三苯基甲基钟阳离子可萃取Cu(SCN)32-、Co(SCN)42-和Fe(SCN)63-。3
本词条内容贡献者为:
王宁 - 副教授 - 西南大学
责任编辑:科普云
 科普中国APP
科普中国APP
 科普中国微信
科普中国微信
 科普中国微博
科普中国微博

最新文章
-
为何太阳系所有行星都在同一平面上旋转?
新浪科技 2021-09-29
-
我国学者揭示早期宇宙星际间重元素起源之谜
中国科学报 2021-09-29
-
比“胖五”更能扛!我国新一代载人运载火箭要来了
科技日报 2021-09-29
-
5G演进已开始,6G研究正进行
光明日报 2021-09-28
-
“早期暗能量”或让宇宙年轻10亿岁
科技日报 2021-09-28
-
5G、大数据、人工智能,看看现代交通的创新元素
新华网 2021-09-28













微信扫一扫:分享
微信里点“发现”,扫一下
二维码便可将本文分享至朋友圈。