如图所示,原子分布在立方体的各结点和各面的中中心处的结构,称为面心立方体。
定义面心立方体,每个面上都有一个原子。FCC系统的晶胞如图所示。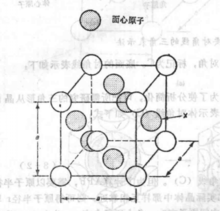 这种结构除顶角上有原子外,在晶胞六个面的中心处还有6个原子,故称为面心立方。1
这种结构除顶角上有原子外,在晶胞六个面的中心处还有6个原子,故称为面心立方。1
相关概念面心立方晶格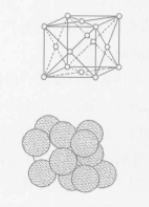 如图,原子分布在立方体的各结点和各面的中心处,角上结点的原子为8个晶胞所共有,面上的原子为2个晶胞所共有,因此,属于每个品胞的子数应为4个,属于面心立方品格的金属有铜、铝、镍、金、银、r铁等,大多数金属在形成固体后只有一种晶体结构,但少数金属在不同温度时它的晶体结构不同,纯铁在1390℃-910℃时称为r铁,属于面心立方晶格,属面心立方晶格的金属塑性都非常好。2
如图,原子分布在立方体的各结点和各面的中心处,角上结点的原子为8个晶胞所共有,面上的原子为2个晶胞所共有,因此,属于每个品胞的子数应为4个,属于面心立方品格的金属有铜、铝、镍、金、银、r铁等,大多数金属在形成固体后只有一种晶体结构,但少数金属在不同温度时它的晶体结构不同,纯铁在1390℃-910℃时称为r铁,属于面心立方晶格,属面心立方晶格的金属塑性都非常好。2
体心立方晶格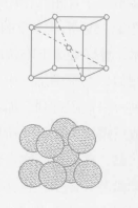 如图,在晶胞的角上和中心处各有1个原子,角上的原子为8个品胞所共有,中心处的原子为晶胞所独占,所以每个品胞的原子数数为1/8×8+1=2个,属于体心立方品格的金属有络、钼、钨、钒、铌、a铁等(当纯铁在1390℃-1539℃之间和910℃以下时叫a铁,是体心立方品格),体心立方晶格的金属一般都有较高的熔点、相当大的强度和较好的塑性。
如图,在晶胞的角上和中心处各有1个原子,角上的原子为8个品胞所共有,中心处的原子为晶胞所独占,所以每个品胞的原子数数为1/8×8+1=2个,属于体心立方品格的金属有络、钼、钨、钒、铌、a铁等(当纯铁在1390℃-1539℃之间和910℃以下时叫a铁,是体心立方品格),体心立方晶格的金属一般都有较高的熔点、相当大的强度和较好的塑性。
密排六方晶格 如图,晶胞是6方柱体形状,6方柱体的12个角上结点各有1个原子,顶面、底面的中心各有1个原子,晶胞体内对称的位置有3个原子,属于每个晶胞的原子数为1/6x12+3+1/2×2=6个。属于密排六方晶格的金属有镉、锌、镁、钻、B铬等。它们的特点是塑性差。晶体结构是密排六方体系。“密排”这一名称就显示这种晶体结构是种高密度的原子堆积排列,类似fcc。这一晶系与fcc排列不同之处在于它的第三层原子直接在第一层之上。
如图,晶胞是6方柱体形状,6方柱体的12个角上结点各有1个原子,顶面、底面的中心各有1个原子,晶胞体内对称的位置有3个原子,属于每个晶胞的原子数为1/6x12+3+1/2×2=6个。属于密排六方晶格的金属有镉、锌、镁、钻、B铬等。它们的特点是塑性差。晶体结构是密排六方体系。“密排”这一名称就显示这种晶体结构是种高密度的原子堆积排列,类似fcc。这一晶系与fcc排列不同之处在于它的第三层原子直接在第一层之上。
发展历史1998年,Jarkov等在分析多晶体电子行射图谱的基础上,认为新金刚石是面心立方结构,其晶格常数为3.57A。2001年,Konyashin等人通过电子衍射、电子能量损失谱(EEIS)和半经验的能量计算认定新金刚石为面心立方结构的纯碳,其晶格常数为3.563A。 Konyashin的半经验计算结果认为。面心立方结构的碳在晶格常数为3.68A时存在能量的局部最小值。也就是面心立方结构的碳是亚稳相3。
然而,最近的第一性原理计算却引起了对fcc碳稳定性的争论。 Pickard等人更精确的第一性原理的能量计算结果表明,fcc碳的晶格常数应该为3.08A,也就是说晶格常数为3.57A左右的fcc纯碳并不是真正的亚稳相。 Murrieta等人的第一性原理的能量计算结果也进一步证实了Pickard的计算结果。 Murrieta认为,晶格常数约为3.57A的fcc碳能够稳定存在的原因可能是由于衬底的作用和夹杂的原因,然而,真正的fcc碳的稳定性的原因还需要继续的实验和理论的研究。显然,,Konyashin的半经验能最计算结果过高地估计了fcc碳的晶格常数和稳定性。
本词条内容贡献者为:
程鹏 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国