电极-电解质系统是化学能与电能互相转化的电化学电池装置,它可以分为原电池和电解池两大类。原电池能自发地将化学能转化为电能;电解池则需要消耗外部电源提供电能,使电池内部发生化学反应。很多电池当实验条件改变时,原电池和电解池能相互转化1。
概述电极-电解质系统是化学能与电能互相转化的一种电化学反应器。如果自发地将化学能变成电能,这种电极-电解质系统称为原电池;如果实现电化学反应的能量由外电源供给,则这种电极-电解质系统称为电解池。原电池将化学能转变为电能,电解池将电能转变成化学能。每个电极-电解质系统都由两个称之为电极的导体和与之接触的电解质溶液构成。一支电极和与其相接触的电解质溶液构成一个半电池,两个半电池构成一个电极-电解质系统。
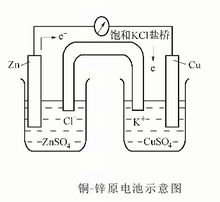 在电极-电解质系统中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。在右图所示的铜-锌原电池中,阳极和阴极上发生的氧化还原反应如下:
在电极-电解质系统中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。在右图所示的铜-锌原电池中,阳极和阴极上发生的氧化还原反应如下:
阳极(锌极、负极): Zn-2e→Zn2+
阴极(铜极、正极):Cu2++2e→Cu
原电池的总反应为:Cu2++Zn→Cu+Zn2+
若外加电压大于原电池的电动势,则铜-锌原电池变成电解池:
阳极(铜极、正极):Cu-2e→Cu2+
阴极(锌极、负极):Zn2++Cu→Zn
电解池的总反应为:Zn2++Cu→Zn+Cu2+
上述反应是铜锌原电池反应的逆反应。显然,原电池的电池反应自发进行;电解池的电池反应不能自发进行。在电位法中使用的测量电池均为原电池1。
电极电极-电解质系统中两个电极可以称为阳极和阴极。它们划分依据是:凡是发生氧化反应的电极称为阳极,凡是发生还原反应的电极称为阴极。因此,原电池正极是阴极,负极是阳极。应用时应加以注意,一般原电池的电极常称为正、负极,而电解池和腐蚀电池的电极常称为阴、阳极2。
可逆与不可逆系统电极-电解质系统可分为可逆电池和不可逆电池两种。可逆电池系统满足以下要求:
(1)在电池构造方面,构成电池的两极必须是可逆的,即有相反方向的电流通过电极时所进行的电极反应必须恰好相反。
(2)在工作条件方面,电池无论是放电或充电时,都要在电流极微小的条件下进行即同一电势下进行2。
本词条内容贡献者为:
王宁 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国