单元系,又称一成份系、一元系。是组成一个体系的基本单元或由一种纯物质组成的系统。
根据相律,对于单元系有:F=1- φ+ 2=3- φ,最大可能的自由度数为2。讨论单元系时常用的3个势函数是T、P、μ,因为是单元系,化学势μ就是摩尔吉布斯自由能。3个强度量只有两个是独立的,一般选取温度T和压力P为独立变量做出P-T相图。
简介组成一个体系的基本单元,例如单质(元素)和化合物,称为组元。体系中具有相同物理与化学性质的,且与其他部分以界面分开的均匀部分称为相。通常把具有n个组元都是独立的体系称为n元系,组元数为一的体系称为单元系。
处于平衡状态下的多相(P个相)体系,每个组元(共有C个组元)在各相中的化学势都必须彼此相等。处于平衡状态的多元系中可能存在的相数将有一定的限制。这种限制可用吉布斯相律表示之:
F=C-P+2
式中,F为体系的自由度数,它是指不影响体系平衡状态的独立可变参数(如温度、压力、浓度等)的数目;C为体系的组元数;P为相数。
对于不含气相的凝聚体系,压力在通常范围的变化对平衡的影响极小,一般可认为是常量。因此相律可写成下列形式:
F=C-P+1
相律给出了平衡状态下体系中存在的相数与组元数及温度、压力之间的关系,对分析和研究相图有重要的指导作用。
单元系相图单元系相图是通过几何图形描述:由单一组元构成的体系在不同温度和压力条件下可能存在的相及多相的平衡。现以H2O为例,说明单元系相图的表示和测定方法。
H2O可以以气态(水汽)、液态(水)和固态(冰)的形式存在。绘制H2O的相图,首先在不同温度和压力条件下,测出水-气、冰-气和水-冰两相平衡时相应的温度和压力,然后,以温度为横坐标,压力为纵坐标作图,把每一个数据都在图上标出一个点,再将这些点连接起来,得到如图中(a)所示的H2O相图。
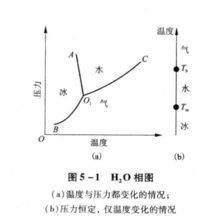
图中(a)中有三条曲线:水和蒸气共存的平衡曲线O1C;冰和水气共存的平衡曲线O1B;水与冰共存的平衡曲线O1A。他们将相图分为3个区域:水气区、水区和冰区。在每个区中只有一相存在。在O1A,O1B和O1C三条曲线上,两相平衡(共存)。O1A,O1B和O1C三条曲线交于O1点,它是气、水、冰三相平衡点。1
如果外界压力保持恒定(如一个标准大气压),那么单元系相图只要一个温度轴来表示,如H2O的情况见图中(b),在气、水、冰的各单相区内,温度可在一定范围内变动。在熔点和沸点处,两相共存,故温度不能变动,即相变为恒温过程。
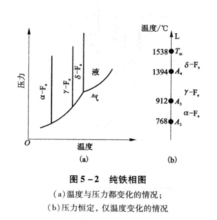
在单元系中,除了可以出现气、液、固三相之间的转变外,某些物质还可能出现固态中的同素异构转变。例如,图中(a)是纯铁相图,其中δ-Fe和α-Fe是体心立方结构,两者点阵常数略有不同,而γ-Fe是面心立方结构。图中三个相之间有两条晶型转变线把它们分开。对金属一般只考虑沸点以下的温度范围,同时外界压力通常为一个标准大气压,因此,纯金属相图可以用温度轴来表示,见图中(b)。Tm(1538℃)是纯铁的熔点;A4点(1394℃)是δ-Fe和γ-Fe的转变点;A3点(912℃)是γ-Fe和α-Fe的转变点;A2点(768℃)是磁性转变点。
除了某些纯金属,如铁等具有同素异构转变之外,在某些化合物中也有类似的转变,称为同分异构转变或多晶型转变。由于化合物结构较金属复杂,因此,更容易出现多晶型转变。例如,全同聚丙烯在不同的结晶温度下,可形成单斜(α型),六方(β型)和三方(γ型)3种晶型。又如在硅酸盐材料中,用途最广、用量最大的SiO2在不同温度和压力下可有4种晶体结构的出现,即α-石英、β-石英、β2-鳞石英、β-方石英。1
单元系晶体结构元素晶体结构的有周期关系,依据晶体结构及结合键特性,分为如下的三类:
(1)第一类:金属键元素。由于金属键没有方向性,因而每个原子的周围有尽可能多的邻居,即配位数高,且邻居原子的对称性高。这两个特点还导致另一特点,即这类元素晶体密堆程度高。绝大多数金属都是选择了满足这三个要求的晶体结构,等径球在三维空间密堆时,最大的配位数为12,可形成面心立方(fcc)或密排六方(hcp)结构;体心立方(bcc)结构虽然配位数只是8,但6个次近邻原子只比8个最近邻原子远13.4%,因此,绝大多数金属都选择了fcc、bcc及hcp结构(分别简称为A1、A2及A3结构)。少数采取复杂晶体结构的金属,例如α-Mn、β-Mn、α-U等,则在金属键之外,还杂有许多的其他结合键。
(2)第二类:这类元素虽具有金属键特性,但由于ⅡB族的Zn、Cd、Hg的配位数也遵循(8-N)规律;Ga的晶体结构较为复杂;In、Tl、Sn、Pb的离化不完全。这8个元素的熔点都较低,依据这些特点,将它们列为第二类元素。
(3)第三类:这类元素的晶体结构较为疏松,为共价键晶体,其配位数等于(8-N),而N为元素在周期表中的族序。自ⅦB至ⅣB族,随着8-N值从1增至4,共价键数也随着增加,其升华热值也随着增加。例如,氯、硫、磷及硅晶体的升华热分别为134.7、276.1、333.9及451kJ/mol。2
单元系相图应用碳的单元系相图是很有实用价值的相图之一,如右图所示。从相图来看,在很宽的温度和压力范围内石墨(碳) 都可以转变为金刚石,但是只有在高温和高压下,并且有液态金属触媒剂或矿物触媒剂作用的情况下,这种转变才能以实际可接受的速度进行。
都可以转变为金刚石,但是只有在高温和高压下,并且有液态金属触媒剂或矿物触媒剂作用的情况下,这种转变才能以实际可接受的速度进行。
可以通过图中的曲线走势验证相图邻接关系的规则。例如,在图中看到,从液相区进入液相和气相两相区,没有相的消失,但增加了气相,即D- =0和D+ =1。相图是二维的,R=2,故Rˊ=1,即说明液相区和液、气两相区的邻接区是一条线,实际上这条线就是两相平衡相线。又例如从液相区进入三相平衡区(三相点),这时没有相消失,D- =0,但增加了两个相D+ =2。相图是二维的,R=2,故Rˊ=0,即说明液相区和三相区邻接区是一个点,实际上这个点就是三相区本身。还注意到,在不变平衡点(三相平衡点),从单相区进人三相区(或相反),似乎违背了相邻相区的相的数目应相差1的规律,在这些特殊点处,应该看做是单相区同时进人两个两相区,分开来看单相进人各个两相区,这也是符合规律的。
在工程上还广泛应用另一种相图,即以热力学势和自身共轭广延量作变量所构成的图,例如p-V、T-S图。它们有一定的实用价值。这些图中的面积表达体系和环境交换的可逆功。3
本词条内容贡献者为:
李航 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国