氧化还原是一类广泛存在的重要反应,所谓氧化还原反应是指电子从一种物质转移到另一种物质上的化学反应。在氧化还原反应中,得到电子的物质是氧化剂,失去电子的物质是还原剂;还原剂失去电子被氧化,氧化剂得到电子被还原。氧化反应往往是可逆的,在还原剂供出电子后变成氧化剂,作为氧化剂又可以接受电子变成还原剂。还原剂失去电子的倾向(或氧化剂得到电子的倾向)的大小,则称为氧化还原电势。在标准条件下,每一个氧化还原电对都有一个标准的氧化还原电势。
氧化还原电势的测定1889年,德国化学家能斯特(H.W.Nernst)提出了双电层理论来说明电势差及原电池产生电流的机理。根据双电层理论,当把一金属电极M放人它的盐溶液就构成一个半电池,在金属与其盐溶液的接触面上会发生两个不同的过程:一个金属表面的阳离子受极性水分子的吸引进入溶液的过程(金属越活泼,溶液越稀,这种倾向越大);另一个是溶液中的水合金属离子在金属表面受到自由电子的吸引而沉积在金属表面的过程(金属越不活泼,溶液浓度越大,这种倾向越大)。当这两种方向相反的过程进行的速率相等时,即达到动态平衡:M=Mn++ne-,前一个过程的结果是在金属与其盐溶液的接触界面建立起由带负电荷的电子和带正电荷的金属离子所构成的双电层。后一个过程在平衡时金属表面聚集了金属离子而f带正电荷,溶液带负电荷,从而构成了相应的双电层,这种双电层之间就存在一定的电势差。
事实上,电极电势的绝对值无法测定,只能选定某一电对的电极电势作为参比标准,将其他电对的电极电势与它比较而求出各电对平衡电势的相对值。根据国际纯粹与应用化学联合会( IUPAC)的建议,通常选标准氢电极为参比标准,所测得的电势称氢标电势,并且规定氢标准电极电势为零。标准氢电极是由一个镀有铂金的铜电极,在25℃一个大气压时,浸于氢离子活度为1kg/mol的溶液中,其pH=0(标准状态)而组成的。
由两个电极即两个半电池组成的原电池,其电极电势(E)之差即电动势可以测量。其间关系为:ε=E正极-E负极,根据物质的氧化还原能力,可以看出电极电势代数值越小,电对所对应的还原型物质还原能力越强,氧化型物质氧化能力越弱;电极电势代数值越大,电对所对应的还原型物质还原能力越弱,氧化型物质氧化能力越强。因此,电极电势可以表示氧化还原对所对应的氧化型物质或还原型物质得失电子能力(即氧化还原能力)的相对大小。
经过测量氢锌电池和铜锌电池的电动势,得到锌的标准电极电势为-0.763V,铜的标准电极电势为+0. 34V。因此,锌的还原能力强,而铜离子的氧化能力强。还原剂失掉电子的倾向(氧化剂得到电子的倾向)称为氧化还原电势。在实际工作中,由于氢电极使用不便,因此常用易于制备、使用方便而且电极电势稳定的甘汞电极等作为电极电势的对比参考,称为参比电极。1
氧化还原电势与自由能的关系生物氧化过程中发生的生化反应的能量变化与一般化学反应一样可用热力学上的自由能变化来描述。自由能(freeenergy)是指一个体系的总能量中,在恒温恒压条件下能够做功的那一部分能量,又称为Gibbs自由能,用符号G表示。物质中的自由能(G)含量是不易测定的,但化学反应的自由能变化(ΔG)是可以测定的。ΔG很有用,它表示从某反应可以得到多少有用功,也是衡量化学反应的自发性的标准。例如,物质A转变为物质B的反应:ΔG=GB-GA,当ΔG为负值时,是放能反应,可以产生有用功,反应可自发进行;若ΔG为正值时,是吸能反应,为非自发反应,必须供给能量反应才可进行,其逆反应是自发的。
ΔG=ΔG0-In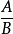 ,如果ΔG =0时,表明反应体系处于动态平衡状态。此时,平衡常数为K,由已知的K可求得ΔG0:ΔG0=-RTInK。
,如果ΔG =0时,表明反应体系处于动态平衡状态。此时,平衡常数为K,由已知的K可求得ΔG0:ΔG0=-RTInK。
在一个氧化还原反应中,可从反应物的标准氧化还原电势E0计算出这个氧化还原反应的自由能变化(ΔG0),ΔG0与氧化还原电势的关系如下:ΔG0=-nFΔE0,其中n表示转移的电子数,F为法拉第常数(1法拉第=96485C/mol),ΔE0的单位为V,ΔG0的单位为J/mol。当ΔE0为正值时,ΔG0为负值,是放能反应,反应能自发进行;ΔE0为负值时,ΔG0为正值,是吸能反应,反应不能自发进行2。
氧化还原电势的作用1、氧化还原电势首先可以比较氧化剂或还原剂的相对强弱,电极电势的大小反映物质在水溶液中氧化还原能力的强弱。电极电势高,对应电对中的氧化型物质是强氧化剂;还原型物质是弱还原剂;电极电势低,对应电对中的还原型物质是强还原剂,氧化型物质是弱氧化剂。
2、氧化还原电势其次可以计算原电池的标准电动势E0和电动势E,在组成原电池的两个半电池中,电极电势代数值较大的半电池是原电池的正极,电极电势代数值较小的半电池是原电池的负极。原电池的电动势等于正极的电极电势减去负极的电极电势。
3、氧化还原电势还可以判断氧化还原反应进行的程度,化学反应进行的程度可以根据标准平衡常数来衡量,氧化还原反应的标准平衡常数可根据有关电对的标准电极电势求得,因此,用电极电势可以判断氧化还原反应进行的程度。
4、氧化还原电势能测定溶液的pH及物质的某些常数弱酸的pH、解离常数K、难溶化合物的溶度积Ksp、配合物的稳定常数Kf等都可以用测定电池电极电势的方法求得。3
5、最后氧化还原电势在生物领域内有一定的应用,我们知道机体环境中的氧化还原电势和它的含氧量有着密切的相关性。环境中的氧浓度减少,由于还原作用而造成氧化还原电势降低,因此氧浓度与氧化还原电势之间有密切关系, 但两者对厌氧菌的生长繁殖还没有完全弄清楚。正常人组织中的氧化还原电势约为+150mV,而人体大肠中的氧化还原电势约为-250mV, 因此含有大量的厌氧菌。普通培养基在有氧的环境下,氧化还原电势在+300mV左右,而厌氧菌需在-200mV左右才能生长,故厌氧菌培养必须与氧隔绝,或降低培养基的氧化还原电势。Hanke等(1943)提出环境中的氧化还原电势是厌氧菌生长的决定性因素,他们认为某些厌氧菌培养在氧化还原电势低的培养基上, 即使放在有氧的气体中也能生长。但也有人认为对厌氧菌生长起决定性作用的是氧张力,而不是氧化还原电势,如类杆菌、突破芽胞梭菌、扩大消化链球菌等多种厌氧菌,均能在无氧环境下生长,并不受环境中氧化还原电势的影响4。
本词条内容贡献者为:
尹维龙 - 副教授 - 哈尔滨工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国