软酸(soft-acid)即路易斯酸,具有体积大、正电荷少、易极化、易失去电子、易形成共价性较强的键的物质。软酸易与软碱生成稳定的络合物;软酸不易与硬碱生成络合物,或生成的络合物不稳定,常见的Cu+、Ag+、Hg+、Cd2+等,均属软酸。软硬酸碱的溉念,是对路易斯酸碱概念的发展。1
软酸为中心离子的配位催化低价金属离子配合物和反馈键起主导作用的配位络合催化剂,包括第一周期低价过渡金属与CO、烯烃的配合物,以及第二、三周期过渡金属的烯烃配合物。
烯烃的氢醛化反应(羰基合成,OXO-synthesis),双键异构化和N2分子的配位活化都是具有重要意义的催化反应。
软酸配合物的性质Pauling提出的化合物电中性原则是普遍法则,配合物当然不能例外,中心离子的正电荷须由配体的负电荷来中和。另一个规则就是前述的有效原子序数规则(EAN),这个规则对典型元素是成立的,但对过渡元素就缺乏普遍适用性了。前面已经介绍过,有些过渡金属配合物很稳定,但不符合EAN规则,这是因为过渡金属的d、f轨道在形成配位键时,能发挥特有的稳定性。
例如降低中心离子的原子价,这意味着从外界加入了电子,电子数增加了,为了维持配合物的稳定性,根据电中性原则须设法(例如氧化反应)把这部分电子移出。如果仍要维持中心离子的低价状态,而又使配合物有一定的稳定性,就只好把这部分电子通过。给予,或寄存到配体的低能空轨道的办法,在配合物分子内部解决。
第二、三周期过渡金属的电负性与碳原子相近,4d、5d轨道又与配体分子轨道显著重叠,低价态自不待言,正常价态(+2,+3,+4)也能形成M--C的σ键,能形成CO、烯烃配合物,它们比第一周期过渡金属配合物更稳定。
第一周期低价过渡金属离子和第二、三周期过渡金属离子,能与含碳化合物形成π键和σ键配位,这种配位可用于调控有机化合物的某些反应。例如:
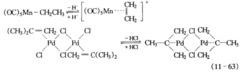
双键移动及异构化固体酸可由强质子加成一脱离来催化烯烃的双键异构化。本节介绍的催化过程是由第一周期低价过渡金属丌配合物(如羰基、羟羰基配合物),以及第二、三周期过渡金属化合物,特别是卤化物来实现的。
Cramer等报道RhⅠ、PtⅡ、PdⅡ、Nii0和Fe0化合物,在能提供氢源的共催化剂(酸)存在下,可使丁烯异构化的催化反应在氘化溶剂中进行。1一丁烯在CH3OD中异构化生成d-1一丁烯,不生成d一2一丁烯。下图是丁烯异构化的H一D交换历程。
下图 A是H—D交换循环,B是丁烯异构化循环。它们的相对反应速度取决于催化剂和烯烃。PtⅡ,H一D交换优先;RhⅠ、DFe(CO)4-、LiPdCl4和Ni(P(OEt)3)4则异构化优先。这些催化剂都有顺反异构化功能。

已知在Pd催化剂上有烯丙基吸附,后者对异构化反应有阻碍,这可能是因为π-烯丙基是稳定的配位体,影响了配位体交换。
有双键的环辛二烯,用Fe(CO)5异构化是1,5-COD→1,3-COD反应,对形成共轭双键有利;用RhCl3催化则情况相反,是1,3-COD→1,5-COD。从热力学角度看,有共轭双键的1,3-COD稳定,故Fe(CO)5的催化反应是正常的;Rh的情况是因为1,5-COD与Rh能形成稳定的螯合型π配合物,所以使反应转向更稳定的方向。与1,5-COD不形成稳定配合物的IrHCl(PPhEt2)和RhCl3(PPhEt2)3都是1,5-COD→1,3-COD的优秀催化剂。2
硬酸和软酸;硬碱和软碱路易斯定义碱是能给出电子对而形成配价键的物质,而酸是能承受电子对的物质。按此定义,所有配位体是碱,而所有金属离子是Lewis酸称为“软”碱的配位体、其给予原子是高极化度的,具有空的低能位分子轨道。这样的给予原子往往是低电负性和易于氧化的;即价电子的轨道易于变形,常常变到电子本身能够脱离相反,“硬”碱的配位原子是低极化度的,难于氧化、具高电负性、其空分子轨道有高能量,因而不易进出。
类似地,属于“软”酸(按Lewis定义)的金属离子,是低电荷、大体积,并有几个易于受激的外层电子。相反,金属离子是“硬”酸,则有高的正电荷、小体积、并缺乏易于受激的外层电子。
概括起来:硬酸与硬碱生成较强的键,而软酸争与软碱配位结合,这样的络合物往往比由硬酸和软碱,或软酸和硬碱生成的类似络合物要稳定得多。

金属离子按硬酸或软酸分类见右表。这种分法也相当于Ahrland、Chart和DaviesH的a类和b类。如所预料,a类金属离子(硬酸)之络合物的稳定度的次序如下:
N》P>As>Sb
O》S>Se>Te
F>Cl>Br>I
对于b类金属离子(软酸),次序不同:
N《P>As>Sb
O《S~Se~Te
FCd2+>Au3+>Sn4+。 如果出现例外,也能得到解释。如钛(Ⅲ)软于钛(Ⅰ),因为已经失去的电子是原来屏蔽在d层的电子。相似地,锡(Ⅳ)软于锡(Ⅱ),而砷(Ⅴ)软于砷(Ⅲ)。
硬金属离子最好与周期表元素族中最轻的原子配位。软酸最好与同族较重的原子配位,可能是由于这些原子具空的d轨道,而此轨道可以用于作为软酸的金属离子的一些d电子的π键。
从这些考虑可以预料,具惰性气体电子结构的阳离子如Na+、Ca +和Al3+,将最强烈地与“硬”配位体如阴离子氧和氟键合,而难于与氨、氰离子或硫离子等配位体键合。不管其电子结构如何,带高电荷的阳离子对配位体呈现类似的选择,常导致形成羟离子或氧络离子,如VO2+和UO22+。
在任何有关族中,如碱金属离子,或碱土金属离子,若遇小配位体,则络合物的稳定度通常随阳离子体积的增加面减小,而大配位体与较大阳离子的键合较强。 对于通过氧原子成键的多配位基的阴离子配位体,可以观察到居间的性质:EDTA或环己烷-1,2二胺-N,N,Nˊ,Nˊ-四乙酸(CDTA)钙络合物比镁或钡络合物更稳定。
相反,高变形牲阳离子如Cu+、Ag+和Au+与氰离子,碘离子和氨生成的络合物比与氢氧根、氟离子和水生成的络合物强得多。锌、镉和汞(Ⅱ)离子,在其生成络合物性质方面居于中间,但比钙、锶和钡更类似铜(Ⅰ)和银(Ⅰ)。
虽然,在有些情况下,配位场稳定能量或立体化学考虑成为极重要时会发生例外,还是存在下列有用的通则,即在变价离子间,当配位体通过硫或氮成键,则有利于较低氧化态,而当配位体通过氧成键,则有利于较高氧化态。邻工氮菲与铁(n)离手络合物比与铁(m)离子络合物稳定得多;柠檬酸根离子则相反。这种借变化金属离子的价态而改变金属络合物的成键性质之能力,在渡金属的分析化学中,找到了很多有益的应用。例如锰(Ⅱ)和铁(Ⅱ)的EDTA络合物之稳定常数相近,但铁(Ⅲ)的常数大1010倍,所以将铁(Ⅱ)氧化至铁(Ⅲ),在测定锰(Ⅱ)时,很易用EDTA隐蔽铁。
配位体的硬度或软度,能借连接于给予原子的取代基而改变,电子给予基增加软度,电子吸引基增加硬度。在过渡金属离子之间,其络合物的稳定度通常随着从周期表中第一至第二或更高的横排而增加。第一横排的过渡元素,二价金属与某一给定配位体形成的络合物的稳定常数,几乎均服从Irving—Williams序列,
Mn




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国