过渡金属催化偶联反应
过渡金属催化偶联反应是指有机金属试剂与亲电有机试剂在第Ⅰ、Ⅱ和Ⅷ副族的过渡金属催化剂的作用下形成C—C、C—H、C—N、C一()、C—S、C—P或C—M(M指金属)键的反应。作为形成C—C、C—N最为有效的手段之一,过渡金属催化偶联反应在有机化学的许多领域都有广泛应用。
过渡金属催化偶联反应通常用发现者人名命名,如Heck反应、Suzuki反应、Sonogashira反应、Stille反应、Glaser偶联反应、Negishi反应等。
大约100多年前,法国化学家维克多·格林尼(1912年诺贝尔化学奖得主)发现了格氏试剂,其在创造简单的分子时非常有效。但是,由于格氏试剂反应活性太高,在合成更为复杂的分子时,往往会产生大量的副产物,使反应体系变得复杂;另一方面,这类方法一般难以用来合成两个不饱和碳之间的C—C键(如烯基之间、芳基之间或它们二者之间的C—C键)。
因此,自1968开始,随着金属有机化学在20世纪70年代的蓬勃发展,赫克等在人们对铜催化Ullmann反应等改进和提高的基础上,系统地研究了钯催化交叉偶联反应。各种钯等过渡金属催化的交叉偶联的出现,为化学家们提供了有效、精准的工具,化学家们能够研究一种高效合成C—C键,特别是两个不饱和碳之间的C—C键的方法,从而使有机合成进入了一个崭新的时代1。
Pd等过渡金属催化的偶联反应Pd等过渡金属催化的偶联反应如Sonogashira交叉偶联反应、Kumada交叉偶联反应、Suzuki偶联反应、Hiyama交叉偶联反应、Negishi交叉偶联反应、Stifle偶联反应和Heek反应,在有机合成上有重要应用,这些偶联反应机理都涉及氧化加成、金属转移化和还原消除等步骤。
(1)Sonogashira偶联反应
Sonogashira反应通常指在钯/铜混合催化剂的催化下,卤代芳烃或卤代烯烃与端基炔烃之间发生的交叉偶联反应。该反应是制备取代炔烃的很重要的方法。首先催化量的Cu和炔反应生成炔铜,炔铜与Pd(PPh3)2Cl2。发生金属转移化反应,再进行还原消除得到Pd0(PPh3)Cl2。然后零价的钯与RX发生氧化加成,接着与另一当量的炔铜发生金属转移化反应,最后再发生还原消除,生成偶联产物,同时再生成零价钯,从而完成整个催化循环。此类反应中经常有少量的炔的二聚物生成。胺在反应中起着非常重要的作用,首先胺可以促进炔铜的产生,其次可以吸收反应中产生的卤化氢。
Sonogashira反应在有机合成中已经得到了广泛的应用。化学家利用此反应合成了许多构造有趣的化合物。例如利用六溴苯和TMSA的反应可得到一个车轮轴形状的六炔基苯,如图1。
(2)Kumada交叉偶联反应
Kumada交叉偶联反应(有时也称Kharasch交叉偶联反应)是在Ni或Pd催化下,在格氏试剂和一个有机卤代物或三氟磺酸酯等之间进行的交叉偶联反应,如图2。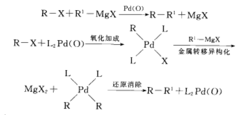
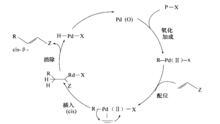
Kumada交叉偶联反应和Negishi、Stille、Hiyama及Suzuki等人名反应一样,都属于同一类Pd催化的有机卤代物或有机三氟碘酸酯或其他亲电物种与有机金属试剂之间的交叉偶联反应。这些反应都有如下所示的催化循环。但Hiyama反应和Suzuki反应稍有不同,有额外的活化步骤来实现金属转移作用。 催化循环如图3。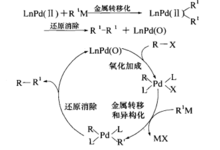
(3)Suzki偶联反应
钯催化下的有机硼烷和有机卤、三氟磺酸酯等在碱存在下发生的交叉偶联反应(若无碱的活化作用金属转移将受到阻碍)。催化循环见Kumada偶联反应。反应机理如图4。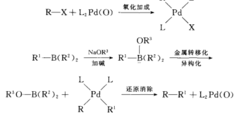
(4)Hiyama交叉偶联反应
钯催化有机硅和有机卤代物或三氟磺酸酯等在诸如F-、OH-之类活化剂存在下发生交叉偶联反应(无活化剂存在时金属转移较难进行)。催化循环参见Kumada偶联。催化循环如图5。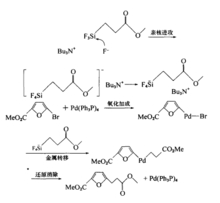
(5)Negishi交叉偶联反应
Pd催化的有机锌和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应,催化循环可见Kumada偶联反应。应机理如图6。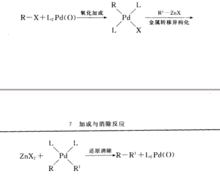
(6)Stille偶联反应
参见Kumada偶联反应。Pd催化的有机锡和有机卤、三氟磺酸酯等之间的交叉偶联反应。应机理如图7。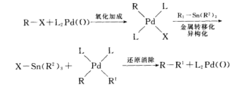
从产物结构类型上看,Suzuki反应与Stille反应很相似。但前者的反应底物为芳香基或烯基硼酸,而且需要加热条件为180℃(左右),而后者无需加热,对结构复杂、不耐受热的产物合成是有利的。
(7)Heck反应
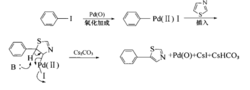
钯催化的有机卤代物或三氟磺酸酯和烯烃之间的偶联反应。应机理如图8。
 发生在杂芳基受体上的分子内或分子间的Heck反应,称为杂芳基Heek反应。应机理如图92。
发生在杂芳基受体上的分子内或分子间的Heck反应,称为杂芳基Heek反应。应机理如图92。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国