化合物分子里的每个原子,都用它的原子轨道与相连原子的原子轨道交迭组成化学键,各化学键之间有一定键角。若被迫产生不正常的键角时,分子里会形成张力。小环化合物的键角小于正常轨道重迭所产生的键角,这样产生的张力就叫小角张力,如环丙烷、环丁烷的小角张力。
用共价键理论解释小角张力要形成化学键,两个原子必须处于原子轨道能发生交叠的位置才能成键;原子轨道的交迭越大,所形成的键越强。当碳与四个原予结合时,它的成键轨道(sp3轨道)指向四面体的四个顶点;任何两个轨道间的夹角都是109.5°;当两个碳原子用sp3轨道互相交迭时,以各原子的sp3轨道彼此正面相对的位置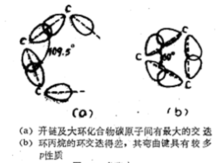 交叠最有效,形成的键也最强;这意味着碳与另外两个碳原子连接时,碳一碳键角应该是109.5°。然而,环丙烷分子中的碳一碳键角只有60°。从量子化学观点看,沿键轴方向重迭产生的碳一碳键角不可能小于90°(纯p),且混入s轨道后角度还要变大。显然,碳原子的sp3轨道不能处于彼此正面相对的位置,轨道交盖较少,生成的键也比一般的碳一碳键弱(见图1);为了既要尽可能沿轴键方向交盖(压缩键角),又要尽可能不致于太大压缩(即不沿正常键轴交盖),只有二者进行协调,结果是形成了弯曲的碳一碳键。 1
交叠最有效,形成的键也最强;这意味着碳与另外两个碳原子连接时,碳一碳键角应该是109.5°。然而,环丙烷分子中的碳一碳键角只有60°。从量子化学观点看,沿键轴方向重迭产生的碳一碳键角不可能小于90°(纯p),且混入s轨道后角度还要变大。显然,碳原子的sp3轨道不能处于彼此正面相对的位置,轨道交盖较少,生成的键也比一般的碳一碳键弱(见图1);为了既要尽可能沿轴键方向交盖(压缩键角),又要尽可能不致于太大压缩(即不沿正常键轴交盖),只有二者进行协调,结果是形成了弯曲的碳一碳键。 1
环丙烷与环丁烷的稳定性低的原因由形成碳——碳键的原子轨道交迭程度差而产生了角张力。1
本词条内容贡献者为:
包申旭 - 副教授 - 武汉理工大学资源与环境工程学院




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国