有一些晶体的结构单元之间存在着几种不同的作用力,晶体的结构不再属于某一种基本晶体类型。这类晶体称为多键型晶体,也称混合键型晶体。
多键型晶体例子典型的例子如石墨,见图右图。石墨为层状结构,同层的每个碳原子以sp2杂化轨道与相邻的三个碳原子形成σ共价键,键角为120°,连接成无限的正六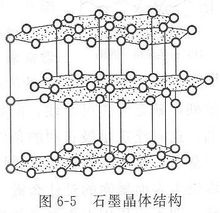 边形的蜂巢状片层结构,键长为142 pm。此外,每个碳原子sp2杂化后都还有一个垂直于层平面(sp2杂化平面)的p轨道,每个p轨道上都有一个自旋方向相同的单电子。这些p轨道相互
边形的蜂巢状片层结构,键长为142 pm。此外,每个碳原子sp2杂化后都还有一个垂直于层平面(sp2杂化平面)的p轨道,每个p轨道上都有一个自旋方向相同的单电子。这些p轨道相互
平行,肩并肩重叠,形成了有多个原子轨道参加的大π键。由于大π键的形成,这些电子可以在整个石墨晶体的层平面上运动,相当于金属晶体中的自由电子,这是石墨具有金属光泽和导电、导热性的原因。石墨层与层之间的距离远大于C—C键长,达340 pm,它们以分子间力互相结合,这种结合要比同层碳原子间的结合弱得多,所以当石墨晶体受到平行于层结构的外力时,层与层间会发生滑动,这是石墨作为固体润滑剂的原因。在同一层中的碳原子之间是共价键,所以石墨的熔点很高,化学性质很稳定。由此可见,石墨晶体是兼有原子晶体、金属晶体和分子晶体的特征,是一种多键型晶体。1具有多键型结构的晶体还有云母、黑磷、六方氮化硼BN(石墨型)等。
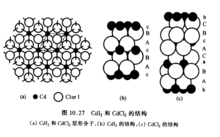
又如CdI2和CdCI2是许多过渡金属卤化物常采取的两种结构型式。这两种类型的结构均为层形结构,具有相同结构的层形分子,如图下图(a)所示。层型分子的堆积方式不同:Cdl2中垂直于层方向重复的周期为一个层形分子的厚度图(b)所示,而CdCl2中垂直于层方向重复的周期为三个层形分子的厚度下图(c)。
多键型晶体——硅酸盐矿物
矿物的晶体不只是单一的一种键型的晶体,还存在多键型晶体-岩石主要由多种硅酸盐(及硅铝酸盐)和石英组成,硅酸盐种类繁多,结构复杂,它是以硅氧四面体(SiO4)为基本构造单位的。硅与氧之间的键是共价键,硅氧四面体之间的键可能是离子键、金属键或分子间力。硅酸盐矿物可根据其硅氧四面体彼此连结方式不同而加以分类和区别。
2
1、 岛状构造的硅酸盐
相邻硅氧四面体间不共用顶角氧,相互不连接而各自孤立存在,形成孤岛状结构硅酸盐,此时络阴离子团以(SiO4)4-形式存在。硅酸盐中的正离子在孤岛状结构中起双重行用,既要引入正电荷保证整个结构的电中性,还需起离子键合作用把带负电的络阴离子团联系起来。橄榄石族矿物中的镁橄榄石(Mg2(SiO4))即为典型的孤岛状结构硅酸盐。
镁橄榄石晶体的单位晶胞包含四个分子单位,即有四个Si原子、八个Mg原子和十六个O原子。结构中的Mg2+与六个等距离的O2-相结合,把孤立的[SiO4]4-络阴离子团相互连接起来。从镁橄榄石晶体结构的空间点阵来看,把氧原子呈近似的六方密堆,在单位晶胞中形成16个八面体空隙和32个四面体空隙.有一半的八面体空隙被Mg2+所占据,而四面体空隙中只有八分之一被占据。Si4+处于四面体空隙中,同时与四个O2-相键合,故其配位数为4;Mg2+处于八面体空隙中同时与六个O相键合,故其配位数为6;每个O2-同时与三个Mg2+和一个Si4+相键合,配位数为4;与每个Si4+的键合强度为1,而与每个Mg2+的键合强度为六分之二。因此,氧总的键合强为1+3X1/3=2,正好使得电价饱和。
在这类结构中,由于是以离子键相连接,键合力强且在各个方向相差不大,因此这类物质表现出较高的硬度,结构稳定且没有明显的解理,如镁橄榄石为一种高度稳定的硅酸盐矿物,熔点高达189℃,是镁质耐火材料中的主要矿物组成。
两个硅氧四面体共用一顶,即硅氧四面体中只有一个顶角上的氧与其他硅氧四面体共用,则形成联岛状结构硅酸盐结构。此时,络阴离子团以(Si2O7)6-形式存在,其结构单元相当于孤岛状结构硅酸盐的两倍,同样依靠引入的阳离子达到电中性并起离子健作用而联系在一起,其表现出来的性质亦与孤岛状结构硅酸盐相近。硅钙石Ca3(Si2O7)即为典型的联岛状结构硅酸盐。
2、环状构造的硅酸盐硅氧四面体共用两顶,即硅氧四面体中有两个顶角上的氧分别与其他硅氧四面体共用,(SiO4)硅氧四面体的连接可在空间不断延伸,所形成的络阴离子团结构通式为(SiO3)n 2n-。当由数个硅氧四面体在空间连接成为闭合环,则得到环状结构硅酸盐络阴离子团。典型的环状结构又分为三节环和六节环,n值分别为8和6,其络阴离子团为(Si3O9)6-及(Si6O18)12-。环状结构的络阴离子团亦依靠引入的阳离子进行连接而得到环状结构硅酸盐。在环状结构硅酸盐中,蓝锥石BaTi(Si3O9)和绿柱石Be3Al2(Si6O18)分别为典型的三节环状和六节环状结构。
3、链状构造的硅酸盐硅氧四面体共用两顶,当其连接在一维方向无限延伸,则得到单链状结构的络阴离子团如下图(a)所示,单元晶胞n=2,络阴离子式为(Si2O6)4-,由于该络阴离子团在一维方向无限延伸,通常将其表示为1∞(Si2O6)4-。此一维方向延伸的硅氧链依靠引入的阳离子连接在一起而形成单链状结构硅酸盐。辉石族矿石中的顽火辉石Mg2(Si2O6)即属于单链状结构硅酸盐,链间由Mg 2+想联系。在Mg2(Si2O6)晶体结构中,(Si2O6)链沿c轴无限延伸,链与链间所形成的空隙被Mg2+填充,每个Mg2+同时与六个氧配位。
在两个相邻连接的硅氧四面体中,其中一个四面体有两个顶角被共用,而另一个四面体有三个顶角被共用,称为平均共用两个半顶角,此时硅氧络阴离子团在一维方向无限延伸,形成双链状结构络阴离子团如下图(b)所示,其络阴离子式为1∞(Si4O11)6-。单元晶胞中包含四个硅,六个非共用氧和五个共用氧。同样,双链间的连接也是依靠引入的阳离子来维系。石棉类矿物角闪石族中的透闪石Ca2Mg5(Si4O11)2(OH)2结构中的双链即是依靠引入的Ca2+、Mg2+与氧间的键合将其连接在一起。

4、层状结构的硅酸盐硅氧四面体中有三个顶角镇分别与其他四面体共用,则得到二维方向无限延伸的硅氧负离子片,用2∞(Si2O5)2-表示。负离子片内是键合较强的极性共价键,而负离子片间可通过结构中引人的阳离子以离子键相连键,也可依靠负离子片间的范德华键相连接而形成层状结构硅酸盐。硅氧层间不同的键合形式将会对层状结构硅酸盐的性质此时非常大的影响。例如,白云母结构中,负离子片间由K +结合,层内及层间均为较强的化学键合,因而解理会难以进行; 滑石结构中层间依靠范德华键结合,层内键合强面层间进合弱,易沿着层面发生解理。该类层状结构材料受外力作用时会沿层面滑动,故在很多场合,如进行单、双杠器械运动时,滑石等常用作固体润滑剂。
层状结构硅酸盐的种类很多,许多天然无机矿物如黏土类矿物(例如高岭土Al2 (Si2O5)(OH)4,蒙脱土等)、云母类矿物(例如白云母KAl2(AlSi3O10 )(OH,F)2 等)以及滑石(Mg (Si2O5 )2(OH)2) 等都是层状结构硅酸盐,均为陶瓷生产中的重要原料。层状结构硅酸盐中,为保证晶体结构的电中性,往往会在结构中引入OH 基团及各种正二价或正三价的阳离子。
5、架状结构的硅酸盐硅氧四面体的所有四个顶角氧均分别与其他硅氧四面体共用,则在三维空间形成规则的架状网络。通常将其表示为3∞(SiO2),这即为纯品态氧化硅的品体结构,如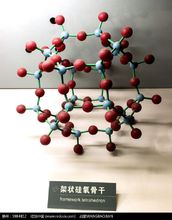 右图所示。
右图所示。
二氧化硅在不同的温度条件和不同的热历史具有不同的品型。立方晶系的方石英是其中最简单的晶型变体,鳞石英和石英是其另外两种晶型变体。
架状结构硅酸盐晶体的(SiO4)中,常有一定数量的Si原子被Al原子置换。这种置换现象只能在两种原子半径相差不大时才能发生,置换的结果不影响晶体的结构状况,称为同晶置换。
进行同晶置换后的晶体,由于Al 原子与Si原子价键的差异,使得一些氧原子产生不饱和的键合轨道,晶体结构达不到电中性。为满足晶体结构的静电价规则,必须引人碱金属原子或其他电正性的原子存在于架状结构的间隙中,其电子进人尚未饱和的氧原子轨道,使整个晶体达到电中性。
高温钾长石 K(AlSi3O8)属于长石族矿物,其架状晶体结构构中,有四分之一的硅原子被铝原子所置。为了保持晶体结构的电中性,每当一个Al 原子取代一个Si 原子,必须同时引人一个K+。其电价除了与网架中(AlO3)的多余电价中和外,还与网架中的公共氧之间产生诱导键键合。
多键型晶体的分类如果一化合物存在两种或两种以上不同的品体结构形式,则称该化合物存在多键型晶体现象。该现象在自然界中也很普遍,当外界条件变化时,品体结构形式发生改变,碳、硅、金属的单质、硫化锌、氧化铁、二氧化硅以及其他很多物质均有这一现象。例如铁在906-1401℃温度范围内为面心立方结构,而超出这一范围则为体心立方结构。碳在自然界中存在金刚石和石墨两种晶型,从热力学观点来说,在一定条件下一种是稳定的品型,另一
种是介稳的晶型,存在晶型的变化,但由于变化速度的缓慢,一旦形成以后,可以以地质年代存在于自然界中。
多键型晶体可大致分为四类。
(1)不改变配位情况的多键型晶体现象 在许多化合物的多晶型晶体中,离子的配位情况基本上不变,但是配位体的连接方式发生改变或是配位多面体发生一定位移。
(2)改变配位情况的多键型晶体现象 这类多键型晶体现象常发生于金属键和离子键型的晶体中。共价键晶体的结构不容易改变配位情况。
(3)分子热运动形成的多键型晶体现象 当温度升高时,晶体中的分子或某些离子团自由旋转,取得较高的对称性,而改变晶体的结构。
(4)具有键型改变的多键型晶体现象 这类多键型晶体现象并不常见。白锡和灰锡的转变是个例子。金刚石和石墨是碳的两种晶型,由于相互间结合力性质的差异使得晶型间的转变非常缓慢而且困难。
上述四种多键型晶体转变,总是由于温度,压力等外界条件变化时发生的。对于压力这个因素的影响较单纯,当压力增高时,促使晶体结构往高密度和高配位的方向转变。而温度因素的影响比较复杂,一般升高温度往往配位数下降,而晶体的对称性提高。
相关拓展对四种晶体类型、结构质点及质点间作用力类型的小结,见下表。
|| || 各类晶体与作用力类型
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国