正电荷通过不在烯丙基位上的双键或三键甚至单键而发生离域的碳正离子,又称碳镒离子,是一个通过闭合多中心键分布正电荷的离域碳正离子,其碳原子呈五价,是二电子三中心键。
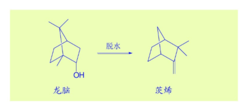
非碳正离子的提出十九世纪末,wagner龙脑脱水成茨烯,认为其中存在碳骨架的异构化重排。
1922年,Meerwein研究茨烯氯代加成物重排为异氯代茨的反应,发现反应速率随着溶液介电常数的增加而增加;氯化氢,氯化铁,氯化铝都能催化这个反应。
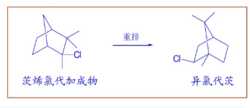
1939年,wilson经过进一步的研究发现,他认为形成的碳正离子具有两电子三中心的结构,由于正电荷是离域的,能量较低,容易形成,因此导致反应的加速进行。1
非碳正离子定义正电荷通过不在烯丙基位上的双键或三键甚至单键而发生离域的碳正离子,又称碳镒离子,是一个通过闭合多中心键分布正电荷的离域碳正离子,其碳原子呈五价,是二电子三中心键。1
与碳正离子的区别经典碳正离子的正电荷是定域的或通过稀丙位共轭离域。
非经典碳正离子的正电荷是通过非烯丙位共轭离域的。与空间位置有关。
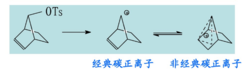
非经典碳正离子的正电荷一般离域在三个碳原子之间,其中两个碳原子彼此通过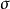 键键合在一起,而第三个碳原子则是通过二电子三中心键与其它两个碳原子键合在一起,呈桥型结构。倒如,降冰片基正离子⑴即属于非经典碳正离子:
键键合在一起,而第三个碳原子则是通过二电子三中心键与其它两个碳原子键合在一起,呈桥型结构。倒如,降冰片基正离子⑴即属于非经典碳正离子:
(I)中C-6是5配位,C-1和C-2是4配位,被称为非经典碳正离子。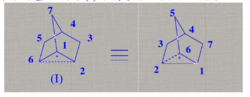 通常认为,C-1和C-2上各具有1/2正电荷,非经典碳正离子是C-6碳原子的sp3杂化轨道与C-1和C-2两个碳原子的p轨道交盖而成的。1
通常认为,C-1和C-2上各具有1/2正电荷,非经典碳正离子是C-6碳原子的sp3杂化轨道与C-1和C-2两个碳原子的p轨道交盖而成的。1
非碳正离子的形成非经典碳正离子可以通过邻基参与形成,既可以通过π键参与,也可以通过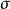 键的参与而形成。邻基参与也称邻基效应,是一种分子内的SN2反应,反应的最终结果,或促进反应速度的异常增加,或限制产物的构型,或导致环状化合物生成,或几种情况兼而有之。
键的参与而形成。邻基参与也称邻基效应,是一种分子内的SN2反应,反应的最终结果,或促进反应速度的异常增加,或限制产物的构型,或导致环状化合物生成,或几种情况兼而有之。
(1)π键参与
甶于对甲苯磺酸基处于碳碳双健的反侧,碳碳双键参与帮助对甲苯磺酸基离去,同时π轨道与缺电子碳原子的 P轨道相互交盖形成了非经典碳正离子 (1), 使正电荷得到分散 ,稳定了碳正离子,因此加速了反应的进行。由于非经典碳正离子在原双键这一侧形成,阻碍了亲核试剂 HOAc从原 C=C 双键这一侧进攻 C- 7,而只能从反侧 进攻 ,因此产物和反应物的构型相同 。
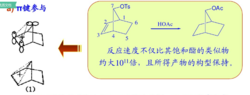
只有甲基所连接的碳原子是非经典碳正离子的组成部分,通过甲基的给电子效应才能使非经典碳正离子稳定,从而证明了反应过程中生成了非经典碳正离子。
(2)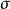 键参与
键参与
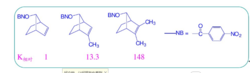
1949年 ,Winstein在研究 2-降冰片基对溴笨磺酸酯的乙酸解反应时,发现如下特征:①无论外型底物还是内型底物都得到外型产物。②反应速率取决于离去基团在 exo或 endo;③具光学活性的外型底物溶剂解得到完全消旋的产物,而光学活性的内型底物则给出8%的净构型转化产物,即54%的构型转化和46%的构型保留。④外型底物的旋光活性消失速率高于溶剂解速率,其比值为4.6,而在相同条件下,光学活性的内型底物没有此现象。
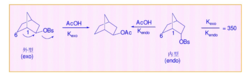
在外型和内型的对溴苯磺酸-2-降冰片酯的乙酸解反应中,决定反应速度的步骤是碳正离子的生成。在外型底物中,由于C-1和C-6之间的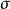 键(成键电子)与离去基呈反式交叉构象,帮助了-OBs的离去,直接形成了桥型非经典碳正离子;而内型底物没有此有利条件,可能先形成经典碳正离子,然后再离域成非经典碳正离子。因此,外型底物的溶剂解速度更快。1
键(成键电子)与离去基呈反式交叉构象,帮助了-OBs的离去,直接形成了桥型非经典碳正离子;而内型底物没有此有利条件,可能先形成经典碳正离子,然后再离域成非经典碳正离子。因此,外型底物的溶剂解速度更快。1
重要的相关知识-碳正离子定义碳正离子是有机化学反应中常见的活性中间体,对它的稳定性和反应活性的研究对某些有机反应历程的阐明是十分重要的,同时对碳正离子稳定性的研究,有助于判断反应是按何种反应历程进行,有助于推断反应所生成的主要产物。
结构和生成
碳正离子是只有6个价电子的缺电子物种,具有高度的亲电性。中心碳原子可以采取sp2杂化,呈平面型结构,未参与杂化的P轨道与该平面垂直;中心碳原子或者可以采取sp3杂化,呈角锥型结构,空着一个未占的sp3杂化轨道。
碳正离子大多采取 sp2杂化的平面型结构,这可能是空间效应及电子效应共同作用的结果: 平面型结构使与中心碳相连的三个基团相距较远; sp2杂化较sp3杂化含有更多的S成分,更靠近原子核;sp2杂化中,空的2p轨道上下两瓣都可以发生溶剂化作用。通过拉曼光谱 、核磁共振及红外光谱 等可以证明 , 简单的烷基碳正离子均为平面结构。
碳正离子的形成过程大概是这样的: 碳原子上原本连有一个电负性较大的或者吸电子的基团(如-Br, -OH等) 那么这个基团就会将它连接的碳上的电子吸引过去 使该碳稍微显正电性吸电子基团在适当溶液中还可能带着一对电子离去(例如溴离子 ),那么剩下的烃基就形成了碳正离子。
碳正离子的种类碳鎓离子被归类为伯,仲,或叔碳正离子,取决于结合到离子化的碳的碳原子的数目是否为1,2或3。
Alkylium离子
碳鎓离子可以直接从制备烷烃除去一个氢负离子,用强酸。例如,魔酸,混合物五氟化锑和氟硫酸变为异丁烷阳离子。
鎓离子
从分子它的名字源于托品(本身命名为分子阿托品)。所述鎓阳离子的盐可以是稳定的,如鎓四氟硼酸盐。它可以从被制成环庚三烯(tropylidene)和溴或五氯化磷。它是一个七边形的,平面的,环状的离子;它也有6π电子(4n+2个,其中,n=1),这满足休克尔规则的芳香。它可以作为一个坐标配位体,以金属原子。
三苯甲基阳离子
三苯基阳离子,是特别稳定的,因为该正电荷能够在10中的碳原子(在3个碳原子的分布邻和对位这三个苯基基团的位置,再加上中心碳原子)。它存在于化合物中的三苯基甲基六氟磷酸盐和高氯酸三苯基。
Arenium离子
一个arenium离子是显示为在一个反应中间体一环己二烯基阳离子电芳香取代。由于历史原因,这种复杂的也被称为韦兰德中间体,或σ络合物。两个氢原子在垂直于苯环键合到一个碳位于一个平面内的arenium离子不再是一个芳香物质;然而它是由于离域相对稳定:正电荷经由离域超过5个碳原子的π系统。
Acylium离子
一个acylium离子是与式RCO阳离子。的结构被描述为RC≡O或RC=O。它是合成的和反应性当量的酰基碳阳离子的,但实际的结构具有的氧和碳通过三键连接。这些物种是常见的活性中间体,例如,在弗里德尔-克拉夫茨酰化也在许多其他有机反应。1
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国