立体化学取向指的是某些加成反应是顺式的,即两个基团会从双键或叁键的同侧进攻;而另一些加成反应是反式的,即从双键或叁键的异侧进攻。环状化合物还存在空间取向的问题。在环烯的顺式加成中,两个基团可能从位阻大的一面进攻也可能从位阻小的一面进攻。此时的规律是,顺式加成通常,但也不是绝对的,从位阻小的一面进攻。
举例例如,4一甲基环戊烯的环氧化产物中,76%是由位阻小的一面进攻得到的,24%是由位阻大的一面进攻得到的。

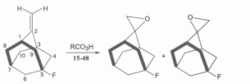
在对环状底物的反式加成中,亲电试剂起始进攻也是从位阻小的一面开始。很多(但不是全部)降冰片烯之类的张力较大的双环化合物的亲电加成是顺式的。在这种情况下,进攻总是发生在外型方向,例如:

如果外型位置已经被7位取代基挡住了,那么内型进攻就占主导地位。例如7,7一二甲基降冰片烯可发生顺式内型环氧化和硼氢化。然而,尽管有7位甲基,7,7一二甲基降冰片烯发生DCl加成、F3CCOOD加成和发生羟汞化反应时都是顺式一外型。与之类似,降冰片烯类化合物的自由基加成反应通常也是顺式外型,尽管也存在反式加成和内型进攻。1
影响因素电子效应也影响进攻的方向。在金刚烷衍生物中,从两面进攻的立体位阻几乎是一样的。但是环氧化反应中,二溴卡宾加成反应和硼氢化反应都几乎发生在含有吸电子氟的那一侧。在给出的例子中,生成的23几乎是24的两倍。在其它底物上也得到了类似的结果。吸电子基团通过场效应(-I)使进攻发生在同面,+I基团使进攻发生在异面。这一结果归因于超共轭效应,在金刚烷的例子中,新生成键的σ*轨道(在22中位于进攻试剂和C—2之间)与对面的Cα—Cβ键的占有电子的d轨道发生重叠,这就是Cieplak效应。LiAlH4还原2位含有轴向甲基环或甲氧基的实验支持了Cieplak的假说。
由于形成溴鎓离子,Br2和HOBr通常发生反式加成,HBr的自由基加成也是反式的。如果这些加成反应的底物是环己烯,那么加成产物不但是反式的而且反应生成的最初产物的构象也是专一的,通常产物的构象是加成基团处于两个直立键,这是因为以双直立键方向打开三元环,可以在过渡态中最大程度地保持反应中心的共平面;的确,环氧化物开环也得到双直立键的产物。起初生成的双直立键的产物会转化为双平伏键的构象,除非环上存在其它可以使后者不如前者稳定的基团。
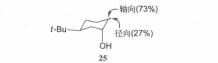
环己烯的自由基加成过程中不生成环状中间体,但自由基的起始进攻仍然是直立键方向。如果反应的总结果是反式加成,那么将得到一个双直立键的初产物。人们也研究过不对称自由基进攻的方向。例如,当自由基25与双键加成时,它优先加在OH基团的对侧,生成一个双直立键的反式加成产物。1
相关扩展手性药物的立体选择性作用,含不对称碳药物为手性药物。很多情况下,手性药物的对映异构体之间都显示明确的生物学差异,例如它们的药理作用可能不同、生物利用度可能不同、分布可能不同、半衰期可能不同、毒性可能不同。手性药物的对映异构体之问的这些生物学差异通常描述为对映选择性。从生物学角度看,手性药物的对映选择性与它们的对映异构体在不对称环境中具有不同的吸收、首过效应、跨膜转运、蛋白结合、生物体转化和排泄有关。从化学角度看,手性药物的对映选择性与它们的对映异构体和酶或其他大分子或大分子结构(抗体或受体)的亲近程度不同有关。2
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国