Diels-Alder反应为可逆反应。有些Diels-Alder反应加成物在发生可逆时会产生2种可能的情况:一是在一定条件下可逆为原来的双烯体和亲双烯体;一是在另一条件下生成新的双烯体和新的亲双烯体。逆Diels-Alder反应在有机化学特别是有机合成中有着广泛而巧妙的应用。
重要的相关知识狄尔斯-阿尔德反应
Diels-Alder reaction,是一种有机反应(具体而言是一种环加成反应)。共轭双烯与取代烯烃(一般称为亲双烯体)反应生成取代环己烯。即使新形成的环之中的一些原子不是碳原子,这个反应也可以继续进行。一些此类反应是可逆的,这样的环分解反应叫做逆狄尔斯-阿尔德反应或逆Diels-Alder反应(retro-Diels-Alder reaction)。1928年德国化学家奥托·迪尔斯和他的学生库尔特·阿尔德首次发现和记载这种新型反应,他们也因此获得1950年的诺贝尔化学奖。狄尔斯-阿尔德反应(Diels-Alder反应,又译作第尔斯-阿尔德等),又名双烯加成,由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的形成碳碳键的手段之一,也是现代有机合成里常用的反应之一。该反应有丰富的立体化学呈现,兼有立体选择性、立体专一性和区域选择性等。
当双烯和亲双烯体两者都有适当的取代基,使反应可能发生不同区位而得到两种产物时,事实上只有一种是主要的。例如异戊二烯与丁烯酮反应,以得到甲基-(4-甲基-3-环己烯基)甲酮为主: 在立体化学方面,这类反应都是顺式加成的,而且当反应物有可能生成内型和外型两种产物时,一般只得内型化合物,例如环戊二烯与顺丁烯二酐的反应。这些立体选择性不但符合大量的实验事实,而且在理论上也能用分子轨道对称守恒原理加以解释。1
定义Diels-Alder反应为可逆反应。有些Diels-Alder反应加成物在发生可逆时会产生2种可能的情况:一是在一定条件下可逆为原来的双烯体和亲双烯体;一是在另一条件下生成新的双烯体和新的亲双烯体。1
重要应用逆Diels-Alder反应在有机化学特别是有机合成中有着广泛而巧妙的应用,从3方面归纳概述如下:
(1)保护基团
环氧苯醌的合成,无法由苯醒直接氧化进行。可利用环戊二烯作为双烯体将苯醌中的一个双键保护起来,然后再用过氧化氢氧化另一双键,最后在髙温下发生逆Diels-Alder反应,生成目标分子。
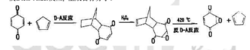
(2)复杂化合物合成简单化
在有机合成中 ,有些化合物很难用一般方法进行合成 ,若巧妙地运用Diels-Alder反应和逆Diels-Alder反应进行设计,则可以实现。例如,重要中间产物丙烯某甲酸甲酯可按如下步骤顺利合成:
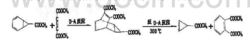
(3)鉴别有机物
具有环己二烯结构的化合物与丁炔乙酸乙酯发生Diels-Alder反应得到的加成物,经过另一温度下的逆Diels-Alder反应,则生成新的亲双烯体乙烯和新的双烯体邻苯二甲酸二乙酯(芳香族化合物,极易鉴别)。而环戊二烯经上述过程不能得到芳香族化合物。据此,可鉴别出具有环己二烯结构的化六物。
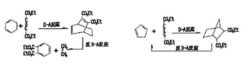
(4)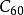 的Diels-Alder反应
的Diels-Alder反应
向从1985年Kroto和Smalley从质谱中确实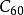 的存在,及1990年Kratchmer等在He气氛下用电弧法制得克量级的
的存在,及1990年Kratchmer等在He气氛下用电弧法制得克量级的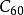 后,由于
后,由于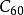 富勒烯独特的电子结构和物理化学性成,引起科学家的普遍关注。尤其是富勒烯的化学可修饰性及其本身和衍生物潜在的应用前景,更使
富勒烯独特的电子结构和物理化学性成,引起科学家的普遍关注。尤其是富勒烯的化学可修饰性及其本身和衍生物潜在的应用前景,更使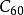 研究空前活跃。氧化反应、还原反应、自由基反应、电荷转移复合物的制备和加成反应,特别是环加成反应已成为
研究空前活跃。氧化反应、还原反应、自由基反应、电荷转移复合物的制备和加成反应,特别是环加成反应已成为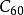 化学修饰的强有力工具。
化学修饰的强有力工具。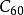 的缺电子特征,使其成为一个很好的Diels-Alder反应的亲烯体 ,再与一系列双烯体进行加成反应,对于
的缺电子特征,使其成为一个很好的Diels-Alder反应的亲烯体 ,再与一系列双烯体进行加成反应,对于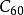 富勒烯衍生物的制备是一个非常显著有效的方法。Dids-Alder环加成反应优先发生在球稀六元环和六元环共用的边。一些例子说明,由于加成产物的低温稳定性,使Diels-Alder反应易于进行,而非常稳定的加成产物己经被制出。
富勒烯衍生物的制备是一个非常显著有效的方法。Dids-Alder环加成反应优先发生在球稀六元环和六元环共用的边。一些例子说明,由于加成产物的低温稳定性,使Diels-Alder反应易于进行,而非常稳定的加成产物己经被制出。
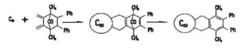
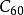 的Dids-Alder反应,人们最平注意到的是与环戊二烯的反应。由于逆Diels-Alder反应之故,加成产物的X-射线衍射晶体结构未能测得。为此,设想了首先形成加成重间体的步骤,成功地得到了Diels-Alder反应产物,并为X-射线衍射证明。1
的Dids-Alder反应,人们最平注意到的是与环戊二烯的反应。由于逆Diels-Alder反应之故,加成产物的X-射线衍射晶体结构未能测得。为此,设想了首先形成加成重间体的步骤,成功地得到了Diels-Alder反应产物,并为X-射线衍射证明。1
本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国