1927年W.H.海特勒和F.W.伦敦首次完成了氢分子中电子对键的量子力学近似处理,这是近代价键理论的基础。L.C.鲍林等加以发展,引入杂化轨道概念,综合成价键理论 ,成功地应用于双原子分子和多原子分子的结构。1931年 ,美国化学家L.Pauling在前人工作的基础上,把杂化轨道理论应用到配合物的研究上,提出了配合物的价键理论。1
基本要点1931年 ,美国化学家L.Pauling在前人工作的基础上,把杂化轨道理论应用到配合物的研究上,提出了配合物的价键理论。其基本要点如下。
1、中心原子与配体中的配位原子之间以配位键结合,即配位原子提供孤对电子,填入中心原子的价电子层空轨道形成配位键。
2、为了增强成键能力,中心原子所提供的空轨道首先进行杂化,形成数目相等、能量相同、具有一定空间伸展方向的杂化轨道,中心原子的杂化轨道与配位原子的孤对电子轨道在键轴方向重叠成键。
3、 配合物的空间构型,取决于中心原子所提供杂化轨道的数目和类型。2
外轨配合物和内轨配合物定义根据中心原子杂化时所提供的空轨道所属电子层的不同,配合物可分为两种类型,即外轨配合物和内轨配合物。
若中心原子全部用最外层价电子的空轨道(ns、np、nd) 杂化成键,所形成的配键称外轨配键,对应的配合物称外轨配合物;另一种是中心原子用了次外层d 轨道,即(n - 1)d和最外层的ns,np 轨道进行杂化成键,所形成的配键称内轨配键,对应的配合物称为内轨配合物。如中心原子采取sp、sp3、sp3d2杂化轨道成键,形成配位数为2、4、6的配合物都是外轨配合物,中心原子采取dsp2或 d2sp3杂化轨道成键形成配位数为4 或 6 的配合物都是内轨配合物。2
影响因素配合物是内轨型还是外轨型,主要取决于中心离子的电子构型、离子所带的电荷和配位原子的电负性大小。
具有(n - 1)d10构型的离子,只能用外层轨道形成外轨型配合物;具有(n - 1)d8构型的离子如在大多数情况下形成内轨塑配合物;具有(n-1 )d4-d7构型的离子,既可形成内轨型,也可形成外轨型配合物;具有(n - 1) d1-3构型的离子,一般形成内轨配合物。这类配合物往往含有空的(n - 1)d轨道,而含有空(n - 1)d轨道的内轨配合物大多不稳定。
中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多时,它对配位原子的孤电子对引力增强,利 于以其层 d 轨道参与成键。电负性大的原子如F、O等 ,与电负性较小的C 原子比较,通常不易提供孤电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型配合物。C原子作为配位原子时 则常形成内轨型配合物 。
内轨型配合物和外轨型配合物,其稳定性是不同的,一般内轨型配合物比外轨型配合物稳定。2
配合物的磁性与键型的关系物质的磁性与组成物质的原子、分子或离子中的电子自旋运动有关,根据磁学理论:配合物中如有未成对的电子,由于电子自旋产生的磁矩不能抵消(成对电子自旋相反 ,磁矩可以互相抵消),就表现出顺磁性,未成对的电子越多 ,磁矩就越大 。配合物如果没有未成对电子,则表现为反磁性。
相反,通过测定配合物的磁矩,也可以了解中心离子的未成对电子数,从而可以确定配合物的磁性(u >0的具有顺磁性,u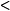 0的具有反磁性)及配合物的键型。
0的具有反磁性)及配合物的键型。
假定配体和外界离子的电子都已成对,那么配合物的单电子数就是中心原子的单电子数。因此,将测得配合物的磁矩与理论值对比,确定中心原子的单电子数由此可区分出内轨配合物和外轨配合物。2
意义与局限性价键理论较好地解释了配合物的空间构型、磁性和稳定性等,在配位化学的发展过程中起了很大的作用。但是,由于价键理论只孤立地看到配体与中心原子之间的成键,忽略了配体对中心原子的作用,到目前为止还不能定量说明配合物的某些性质。如无法定量说明过渡金属配离子的稳定性随中心离子的d 电子数变化而变化的事实 ,也不能解释配离子的吸收光谱和特征颜色。亊实上,配体对中心原子d 轨道的影响是甚大的,它不仅影响了d 电子云的分布,而且也影响了d 轨道的能量,而正是这种能量变化与配合物的性质有着密切的关系。2
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国