简介
绝热膨胀是指与外界没有热量交换,但气体对外界做功,气体膨胀。根据热力学第一定律,可证明这是等熵过程,在这个过程中气体体积增大,压强降低,因而温度降低。
绝热可逆膨胀或压缩过程是在系统内外压力相差无限小的条件下进行的,可用内压代替外压求可逆体积功。
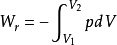
可逆过程的p= f(V)关系称为可逆过程方程,随具体途径而异;对理想气体可逆恒温过程p= nRT/V。1
理想气体可逆绝热过程方程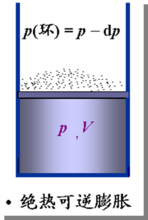
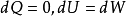
理想气体: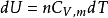 ;
;
过程可逆: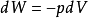
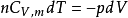
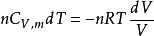
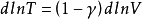
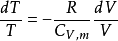
又因为,
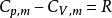
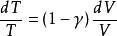
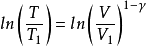
式中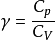 ,称作理想气体的绝热指数。
,称作理想气体的绝热指数。
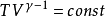
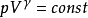
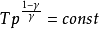
以上三式应用条件:
封闭系统:W'=0,理想气体、绝热、可逆过程。
常见错误:将上式用于绝热非可逆过程!2
可逆绝热过程功的计算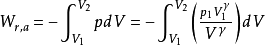
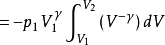
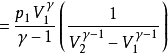
或者
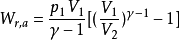

不论可逆与否,绝热过程的功总可以用 W = △U 来进行计算,这种方法往往较容易。
理想气体的绝热可逆线与恒温可逆线的比较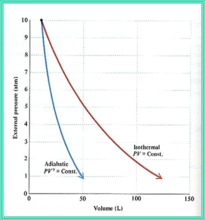
绝热可逆p - V线斜率:
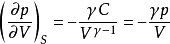
恒温可逆p - V线斜率:
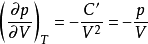
因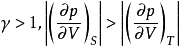 ,即体积膨胀时绝热线的压力下降更快,这是因为绝热时系统不能从环境获取热量,消耗内能作功而导致温度下降。
,即体积膨胀时绝热线的压力下降更快,这是因为绝热时系统不能从环境获取热量,消耗内能作功而导致温度下降。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国