在无机物之间的反应中,是以得失电子数来判断是否发生了氧化还原反应;在有机反应中,用电子对的偏移程度,也就是碳原子周围电子云密度的变化来判断。1
氧化还原当量可由下式求得:氧化还原当量=分子量÷总电子得失(或转移)数。
计算公式氧化还原反应是一种电子得失(或转移)反应,其氧化还原当量可由下式求得:氧化还原当量=分子量÷总电子得失(或转移)数。
在无机物的氧化还原反应中,通常以得失电子书除以其分子量即得其当量;在有机物的氧化还原反应中,以氧化数的变化数除以其分子量,来确定被测物的当量。
相关概念广义氧化还原反应及相关定义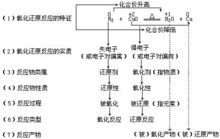 在无机物之间的反应中,是以得失电子数来判断是否发生了氧化还原反应,即在化学反应中,元素或化合物失去电子,化合价升高称之为被氧化,该元素或化合物为还原剂;反之,若得到电子,化合价下降为被还原,称之为氧化剂。
在无机物之间的反应中,是以得失电子数来判断是否发生了氧化还原反应,即在化学反应中,元素或化合物失去电子,化合价升高称之为被氧化,该元素或化合物为还原剂;反之,若得到电子,化合价下降为被还原,称之为氧化剂。
在有机反应中,由于碳均为4价,不能用化合价升高或降低的方法来判断是否发生了氧化还原反应,而是用电子对的偏移程度,也就是碳原子周围电子云密度的变化来判断。即:碳原子周围电子密度升高(部分地得到电子),称之为被还原;而碳原子周围电子密度降低(部分地失去电子),称之为被氧化。这就是“广义氧化还原反应”。1
氧化数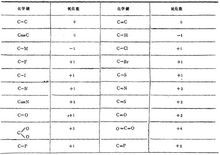 在无机反应中,电子的得失情况可用化合价来表示。
在无机反应中,电子的得失情况可用化合价来表示。
在有机化合物中,电子对的偏移情况可用氧化数来表达。用元素电负性大小来判断化学键极性的方向,也就是电子云的偏移方向。在有机物不同形式的键中,碳的氧化数如图。
凡是电负性比碳大的元素与碳成键,对碳来说,氧化数为正值;而电负性比碳小的元素与碳成键,氧化数为负值。1
差示氧化数法计算有机物氧化还原当量差示氧化数法的定义由于在氧化还原反应中,真正起电子得失(或转移)作用的原子是个别的,其它原子或基团并没有改变,因而,就可以像分数的约分那样,将半反应中反应物与生成物结构中相同的原子或基团约去,使复杂的结构变成简单的几个原子,然后对比反应前后剩余部分氧化数的差值。此差值可命名为“差示氧化数”。
利用“差示氧化数”可以根据以下公式计算氧化还原当量:氧化还原当量=分子量÷差示氧化数。
差示氧化数法的计算步骤:(1)写出反应前后的主要产物,H2O可以不写;
(2)约去反应前后相同的原子或基团;
(3)根据剩余部分来比较氧化数的差值。一般约去后,剩下的不外是氧(氧化数为-2)、氢(氧化数为+1)、卤素(氧化数为-1),即可直接以此值求氧化还原当量或配平反应方程式;
(4)如要知本半反应式是氧化反应还是还原反应,可将左边值减去右边值。当结果为“正”,表示为被氧化;结果为“负”,表示为被还原。2
差示氧化数法的优点(1)利用该法确定有机物的当量,只需知道反应前及反应后的氧化数变化值,而与中间产物无关,即不需要配平反应方程式,就可计算出当量,且不管用什么方法滴定,只要得到同样的产物,氧化当量是一致的。
(2)反应产物若为多种,只要反应是定量的,可将反应前氧化数与反应后的总氧化数变化相减即可。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国