化学反应碰撞理论是在气体分子动理论的基础上发展起来的,该理论认为,发生化学反应的先决条件是反应物分子的碰撞接触,但是并非每一次碰撞都能导致反应发生,反应物分子发生有效碰撞必须满足两个条件:一是能量因素,即反应物分子的能量必须达到某一临界值;二是空间因素,活化分子必须按照一定的方向相互碰撞反应才能发生。1
相关定义有效碰撞 反应物分子间必须相互碰撞才有可能发生反应,但不是每次碰撞都能发生反应。在化学上,把能够发生反应的碰撞称为有效碰撞。2有效碰撞必须满足两个条件:(1)是发生碰撞的分子具有较高的能量;(2)是分子在一定方向上发生碰撞。3
反应物分子间必须相互碰撞才有可能发生反应,但不是每次碰撞都能发生反应。在化学上,把能够发生反应的碰撞称为有效碰撞。2有效碰撞必须满足两个条件:(1)是发生碰撞的分子具有较高的能量;(2)是分子在一定方向上发生碰撞。3
活化分子和活化能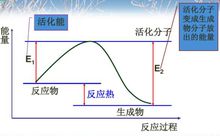 在化学反应中,能量较高,有可能发生有效碰撞的分子成为活化分子。
在化学反应中,能量较高,有可能发生有效碰撞的分子成为活化分子。
活化分子的平均能量与普通反应物分子的平均能量的差值成为活化能。3
提出过程化学反应碰撞理论是在气体分子动理论的基础上于20世纪初发展起来的。1918年,路易斯运用气体分子动理论的成果,以分子碰撞的观点来判断化学反应的发生与否,提出了化学反应的有效碰撞理论。
基本内容反应物分子的碰撞接触是发生化学反应的先决条件,但并不是每一次碰撞都能导致反应发生,发生有效碰撞必须满足两个条件:(1)能量因素,即反应物分子的能量必须达到某一临界值;(2)空间因素,活化分子必须按照一定的方向相互碰撞反应才能发生。即反应物分子必须具备克服分子斥力而“碰到一起”得能量,也就是具备反应物分子之间发生“非弹性碰撞”的能量;活化分子必须按照一定的方向相互碰撞,即需要考虑活化分子发生碰撞的空间因素。
在化学反应速率影响因素分析中的应用 化学反应碰撞理论说明:(1)活化分子的碰撞不一定都是有效碰撞;(2)活化分子数越多,有效碰撞次数就越多,反应速率就越快。因此,化学反应速率快慢可根据浓度、压强、温度、催化剂等不同因素对活化分子发生有效碰撞次数的影响来判断。
化学反应碰撞理论说明:(1)活化分子的碰撞不一定都是有效碰撞;(2)活化分子数越多,有效碰撞次数就越多,反应速率就越快。因此,化学反应速率快慢可根据浓度、压强、温度、催化剂等不同因素对活化分子发生有效碰撞次数的影响来判断。
浓度对化学反应速率的影响**分析:**其他条件不变,增大反应物浓度→单位体积内活化分子数增多→单位时间内有效碰撞次数增多→反应速率增大。4
**结论:**其他条件不变,增大反应物浓度,反应速率加快;减小反应物浓度,反应速率减慢。
注意事项:(1)此规律只适用于气体反应或溶液中的反应,对于纯液体或固体反应物一般情况下其浓度是常数,因此改变他们的量不会改变化学反应速率。(2)化学反应为可逆反应,反应物或生成物浓度的改变,其正反应速率或逆反应速率的变化也符合上述规律。3
压强对化学反应速率的影响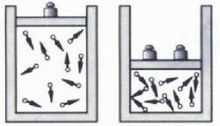 **分析:**其他条件不变,增大压强(减小容器容积)→单位体积内活化分子数增多→单位时间内有效碰撞次数增多→反应速率增大。
**分析:**其他条件不变,增大压强(减小容器容积)→单位体积内活化分子数增多→单位时间内有效碰撞次数增多→反应速率增大。
**结论:**其他条件不变,增大压强(减小容器容积),反应速率加快;减小压强(增大容器容积),反应速率减慢。
注意事项:(1)压强对固体和液体(溶液)间的反应无影响。(2)对于有气体参加的可逆反应,增大压强,正反应速率、逆反应速率都增大;减小压强,正反应速率、逆反应速率都减小。(3)注意“真”变和“假”变。若体系的压强变化而使反应物或生成物的浓度变化即“真”变,否则是“假”变。3
温度对化学反应速率的影响分析:(1)其他条件不变,温度升高→分子获得更高的能量→单位时间内有效碰撞次数增多→反应速率增大。(2)其他条件不变,温度升高→碰撞频率提高→单位时间内有效碰撞次数增多→反应速率增大。
**结论:**其他条件不变,升高温度,反应速率加快;降低温度,反应速率减慢。
注意事项:(1)一般温度每升高10℃,化学反应速率增大到2-4倍;(2)温度对化学反应速率的影响规律,对吸热反应、放热反应都适用。(3)反应若是可逆反应,升高温度,正、逆反应速率都加快;降低温度。正逆反应速率都减慢。
催化剂对化学反应速率的影响**分析:**使用催化剂时,使发生反应所需的活化能降低,这样会使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数,从而使有效碰撞的几率提高,因而使反应速率加快。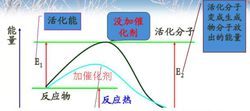
**结论:**其他条件不变,加入正催化剂,反应速率加快;加入负催化剂,反应速率减慢。(没说明时通常指正催化剂。)
注意事项:(1)同一催化剂能同等程度的改变化学反应速率。(2)催化剂只能改变反应速率,不能将不反应变成反应。(3)催化剂有一定的选择性和活化温度。
其他影响因素固体颗粒大小、光、电、射线等。
理论基础在化学反应碰撞理论之前,先后提出物体碰撞理论、气体分子碰撞理论,它们是化学反应碰撞理论的基础。
物体碰撞理论物体运动是物体发生碰撞的前提,物体碰撞是物体运动状态发生变化的前提。
物体的碰撞按照能量因素可分为弹性碰撞和非弹性碰撞,按照空间因素可分为对心碰撞和非对心碰撞。如果碰撞过程中机械能守恒,这样的碰撞叫做弹性碰撞;如果碰撞过程中机械能不守恒,这样的碰撞叫做非弹性碰撞。如果物体碰撞后粘合在一起或者运动速度完全相同,碰撞过程中碰撞系统的动能损失最大,这样的碰撞叫做完全非弹性碰撞。
在弹性碰撞中,碰撞系统遵守动量守恒和机械能守恒。在非弹性碰撞中,碰撞系统依然遵守动量守恒,但在碰撞过程中碰撞系统的动能会转化为系统的内能等其他形式的能量,所以碰撞系统的机械能不再守恒。并且,完全非弹性碰撞中动能转化为内能等其他形式能量的量最大。
气体分子碰撞理论分子运动是分子发生碰撞的前提,分子弹性碰撞是分子运动的重要特征之一,分子运动的特征又是物质宏观属性的微观实质。
气体分子碰撞理论作为分子动理论的重要组成部分,它以“物体是由大量的分子组成的,分子在做永不停息的无规则运动,分子之间存在着引力和斥力”为前提,其主要内容包括:
**(1)气体分子热运动可以看作是在惯性支配下的自由运动。**由于气体分子之间距离很大,而分子力的作用范围又很小,因此,除分子与分子、分子与器壁相互碰撞的瞬间外气体分子间相互作用的分子力是极其微小的;又由于重力的作用一般可以忽略,所以气体分子在相邻两次碰撞之间的运动可以看作是在惯性支配下的自由运动。
**(2)气体分子间碰撞是在分子力作用下的散射过程。**当分子与分子相互靠拢以至彼此相距极近(10-10m)时分子间的相互作用表现为斥力,且这种斥力随着分子间距的进一步减小而急剧地增大,在这样强大斥力作用下,分子与分子又重新分开,这就是所谓的分子碰撞的物理过程。
**(3)气体分子之间的碰撞遵守动量守恒和机械能守恒。**由于气体分子之间的碰撞是“弹性碰撞”,碰撞过程必然遵守动量守恒和机械能守恒。
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国