八面体构型配合物是配位数为6的配离子构型为正八面体的配合物。配体通过配位键与中心离子连接,分别位于中心离子的上下、前后、左右,最终的配体结构为正八面体。八面体构型配合物有两种类型,分别为外轨型八面体构型配合物和内轨型八面体构型配合物。
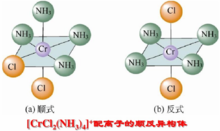
八面体构型配合物的几何异构组成相同而结构不同的分子或者复杂离子叫做异构,八面体配合物的几何异构现象比较普遍,对于[MA4X2]型配合物,比如典型的二氯**.**四氨合铬(III)离子,反式构型的配体为绿色,而顺式构型为紫色:
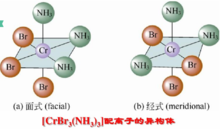
又如[CrBr3(NH3)3]配离子的面式和经式异构:
外轨型八面体配合物和内轨型八面体配合物八面体配合物的中心离子d轨道的电子数为4-7时,形成配合物时有两种情况,一种是外层d轨道参与杂化,形成所谓的外轨型配合物;另一种是内层d轨道参与杂化,形成所谓的内轨型配合物。外轨型配合物和内轨型配合物都是正八面体结构1。
例如Co3+离子:
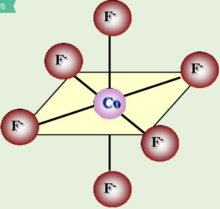
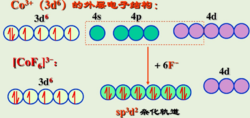
如图三所示,[CoF6]3-配离子的中心离子外层的4d轨道参与杂化,采用的是sp3d2杂化,而3d轨道未参与杂化,3d轨道上电子未重排,有4个未成对电子,为外轨型高自旋配合物。
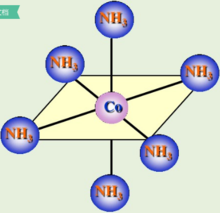

如图四所示,[Co(NH3)6]3+配离子的中心离子内层3d轨道上电子发生重排,没有成单电子,空出两个空的3d轨道参与重排,采用的是d2sp3杂化,为内轨型低自旋配合物。
另一个离子是Fe3+离子,如图五所示:
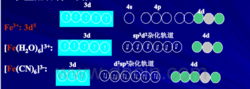
产生上述情况的原因与配体场的强弱有关,当配体场较强时,它可以影响中心离子的d电子,使中心离子的单电子发生配对,让出空轨道,空轨道与4s、4p轨道发生d2sp3杂化,形成内轨型的杂化轨道,这样形成的配合物比较稳定;当配体场较弱时,它不能影响中心离子的d轨道,只能采用sp3d2杂化形成外轨型配合物,这样形成的配合物稳定性较差。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国