尼尔斯·玻尔(Niels Bohr,1885-1962),在卢瑟福模型的基础上,他提出了电子在核外的量子化轨道,解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。bohr氢原子结构理论成功的阐述了原子的稳定性,氢原子光谱的产生和不连续性。
氢原子波尔模型的研究历史20世纪初期,德国物理学家普朗克为解释黑体辐射现象,提出了量子论,揭开了量子物理学的序幕。19世纪末,瑞士数学教师巴耳末将氢原子的谱线表示成巴耳末公式,瑞典物理学家里德伯总结出更为普遍的光谱线公式里德伯公式。然而巴耳末公式和里德伯公式都是经验公式,人们并不了解它们的物理含义。
1905年,瑞士著名物理学家A Einstein对光电效应作成功解释时,提出了光子论,他认为一束光由具有离子特征的光子所组成,每一个光子的能量与它的频率成正比,即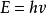 ;h是普朗克常量。在光电效应试验中,具有一定频率的光子和电子碰撞时,将能量传给电子;光子的能量越大,电子得到的能量也越大,发射出来的光电子能量也越大。
;h是普朗克常量。在光电效应试验中,具有一定频率的光子和电子碰撞时,将能量传给电子;光子的能量越大,电子得到的能量也越大,发射出来的光电子能量也越大。
1911年,英国物理学家卢瑟福根据1910年进行的α粒子散射实验,提出了原子结构的行星模型。在这个模型里,电子像太阳系的行星围绕太阳转一样围绕着原子核旋转。但是根据经典电磁理论,这样的电子会发射出电磁辐射,损失能量,以至瞬间坍缩到原子核里。这与实际情况不符,卢瑟福无法解释这个矛盾。
1912年,正在英国曼彻斯特大学工作的玻尔将一份被后人称作《卢瑟福备忘录》的论文提纲提交给他的导师卢瑟福。在这份提纲中,玻尔在行星模型的基础上引入了普朗克的量子概念,认为原子中的电子处在一系列分立的稳态上。回到丹麦后玻尔急于将这些思想整理成论文,可是进展不大。
1913年2月4日前后的某一天,玻尔的同事汉森拜访他,提到了1885年瑞士数学教师巴耳末的工作以及巴耳末公式,玻尔顿时受到启发。后来他回忆到“就在我看到巴耳末公式的那一瞬间,突然一切都清楚了,”“就像是七巧板游戏中的最后一块。”这件事被称为玻尔的“二月转变”。终于,波尔在基于对金属的电子理论和射线穿透能力的研究,引用了能量量子化作为原子稳定的要素,成功解释了氢原子光谱。
1913年7月、9月、11月,经由卢瑟福推荐,《哲学杂志》接连刊载了玻尔的三篇论文,标志着玻尔模型正式提出。这三篇论文成为物理学史上的经典,被称为玻尔模型的“三部曲”。1
波尔氢原子理论的要点(1) 定态假设 原子的核外电子在轨道上运行时,只能够稳定地存在于具有分立的、固定能量的状态中,这些状态称为定态(能级),即处于定态的原子能量是量子化的。此时,原子并不辐射能量,是稳定的。
(2) 跃迁规则 原子的能量变化(包括发射或吸收电磁辐射)只能在两定之间以跃迁的方式进行。在正常情况下,原子中的电子尽可能处在离核最低的轨道上。这时原子的能量最低,即原子处于基态,当原子受到辐射、加热或通电时,获得能量后电子可以跃迁到离核较远的轨道上去,即电子被激发到高能量的 轨道上,这时原子处于激发态。处于激发态的电子不稳定,可以跃迁到离核较近 的轨道上,同时释放出光子。光的频率v取决于离核较远的轨道的能量(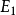 )与 离核较近轨道的能量(
)与 离核较近轨道的能量(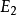 )之差: hv=
)之差: hv=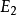 -
-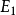
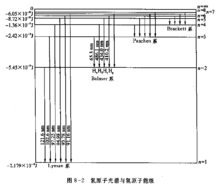
波尔模型对于实验氢原子光谱的解释氢原子在正常情况下,电子处于基态,不会发光。当氢原子受到放电等能里激发 时,电子由基态跃迁到激发态。但处于激发态的电子是不稳定的,它可以自发地回到能量较低的轨道,并以光子的形式释放出能量。因为两个轨道即两个能级间的能童差是确定的,所以发射出来的射线有确定的频率。如可见光谱,即 Balmer线系,就是电子从n=3,4,5.6...能级跃迁到n=2能级时所放出的辐射,其中红线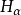 是由n= 3能级跃迁到n= 2能级时放出的;青线
是由n= 3能级跃迁到n= 2能级时放出的;青线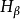 ,蓝紫线
,蓝紫线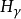 和紫线
和紫线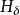 分别是由n=4,5和6能级跃迁到n=2能级时放出的。总之,因为能级是不连续的,即量子化的,造成氢原子光谱是不连续的线状光谱,各谱线有各自的频率值。
分别是由n=4,5和6能级跃迁到n=2能级时放出的。总之,因为能级是不连续的,即量子化的,造成氢原子光谱是不连续的线状光谱,各谱线有各自的频率值。
前面提到,离核最近的电子处于低能级,吸收能量可以跃迁至高能级,如果吸收了足够的能量可以离开原子(原子电离),可认为该电子处于离核无穷远的能级,即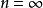 。离开原子的电子与核之间不再有吸引作用,因此,相对于核而言核电子能量是零。氢原子其他
。离开原子的电子与核之间不再有吸引作用,因此,相对于核而言核电子能量是零。氢原子其他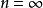 比低的能级,能量皆低于零,均为负值。
比低的能级,能量皆低于零,均为负值。
氢原子光谱中各能级的能量关系式为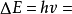
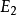 -
-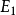
普遍性的氢原子光谱的频率公式为: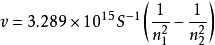
代入简化为: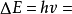
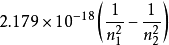
 式子中的
式子中的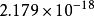 被称为
被称为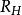 常量。
常量。
当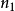 =1,
=1,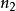 为无穷时,
为无穷时,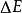 =
=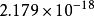 ,这就是氢原子的电离能。
,这就是氢原子的电离能。
当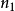 =1,2....n,
=1,2....n,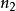 为无穷时,可以计算出氢原子各能级的能量。
为无穷时,可以计算出氢原子各能级的能量。
Bohr理论成功地阐释了原子的稳定性、氢原子光谱的产生和不连续性。1
实验验证编辑
1897年,美国天文学家皮克林在恒星弧矢增二十二的光谱中发现了一组独特的线系,称为皮克林线系。皮克林线系中有一些谱线靠近巴耳末线系,但又不完全重合,另外有一些谱线位于巴耳末线系两临近谱线之间。起初皮克林线系被认为是氢的谱线,然而玻尔提出皮克林线系是类氢离子He+发出的谱线。随后英国物理学家埃万斯在实验室中观察了He+的光谱,证实玻尔的判断完全正确。
和玻尔提出玻尔模型几乎同一时期,英国物理学家亨利·莫斯莱测定了多种元素的X射线标识谱线,发现它们具有确定的规律性,并得到了经验公式——莫塞莱公式。莫塞莱看到玻尔的论文,立刻发现这个经验公式可以由玻尔模型导出,为玻尔模型提供了有力的证据。
1914年,夫兰克和赫兹进行了用电子轰击汞蒸汽的实验,即夫兰克-赫兹实验。实验结果显示,汞原子内确实存在能量为4.9eV的量子态。1920年代,夫兰克和赫兹又继续改进实验装置,发现了汞原子内部更多的量子态,有力地证实了玻尔模型的正确性。
1932年尤雷(H.C.Urey)观察到了氢的同位素氘的光谱,测量到了氘的里德伯常数,和玻尔模型的预言符合得很好。3
波尔氢原子结构模型的重大意义和局限性Bohr的原子结构量子论,开启了人们正确认识原子结构的大门。由于他在 庳子理论和原子辐射方囱做出的卓越贡献,获得丁 1922年的物理学Nobel奖。 玻尔的原子理论第一次将量子观念引入原子领域,提出了定态和跃迁的概念,成功地解释了氢原子光谱的实验规律。Bohr所提出的概念如量子化、能级和电子跃迁等,至今仍被广泛采用。
然而, Bohr的量子论毕竟是建立在经典物理学的基础上,存在问题和局限性是难以避免的。对氢原子光谱的精细结构无法解释,Bohr假改的平面轨道与电子围绕原子核呈球形对称的现象也不符合等.。
实际上,原子中电子的坐标没有确定的值。因此,我们只能说某时刻电子在某点附近单位体积内出现的概率是多少,而不能把电子的运动看做一个具有确定坐标的质点的轨道运动。(测不准原理)
当原子处于不同状态时,电子在各处出现的概率是不一样的。如果用疏密不同的点表示电子在各个位置出现的概率,画出图来,就像云雾一样,可以形象地把它称作电子云。
Bohr理论被人们划定为旧量子论。新量子力学就是在解决旧量子论问题的过程中,继承和发展了物理学的新成果,向人们展示了原子结构的真实面貌。1
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国