简介
pH自动控制系统应用于众多的工业生产过程和废水处理过程。在pH控制过程中,中和试剂供给量变化范围可能达到几个数量级,而且控制过程中的测量信号(pH值)与控制的加药量之间,具有强烈的非线性关系。
pH自动控制系统多采用可编程控制器作为调节器,可以同时输入多种信号,如pH值,输入流量值,储槽液位,控制阀状态等信息。控制系统将输入的各信息量进行一定运算,组成智能性控制系统。当被处理的液体的中和滴定曲线已知时,控制系统可以根据pH测定值准确地计算出需要的中和剂的计量值,准确控制加药量。同时,当整个处理系统确定后,其平衡迟缓可以实地测定,据此,可以抑制甚至排除因平衡迟缓所引起的系统震荡,在保持控制的高灵敏度的同时,保证系统的稳定性。
pH自动控制系统组成相关pH测量设备PH值是用溶液中氢离子浓度的负对数来表示的。是衡量水体酸碱度的一个值,是溶液中氢离子活度的一种标度,也就是通常意义上溶液酸碱程度的衡量标准。PH测量设备由传感器和变送器组成的。PH传感器俗称PH探头,由玻璃电极和参考电极两部分组成,用玻璃电极与参比电极组成原电池。在玻璃膜与被测溶液中氢离子进行离子交换过程中,通过测量电极之间的电位差来检测溶液中的氢离子浓度,从而测得被测液体的PH值,由于PH值与温度有关,所以一般还要增加一个温度电极进行温度补偿。1
玻璃电极是工业上用得最广泛的指示电极, 它能在相当宽的范围内有良好的线性关系,并能在较强的酸、碱溶液中稳定工作。我国目前生产的工业pH 发送器, 由于结构上的原因,不适台工业废水处理谎程中使用, 其主要问题是:(1)参比电极的盐桥常常由于气泡胆阱或KCI结晶析出而造成测量电池回路短路。(2)结构复杂而笨重,日常维护、安装困难。2
PH计的日常维护PH仪传感器的工作电极与参比电极之间的电子通路是通过被测介质进行的,工作电极玻璃膜的沾污会直接影响到测量。若要保持PH的测量敏感性和准确性,玻璃探头的清洗工作是十分重要的。在正常使用中应每天清理一次探头保护管周围的杂物,以便使探头接触到的液体为实测介质。每周对探头进行一次人工清洗,每三个月进行定期校验。测量池要定期排污清理,防止污泥淤积。1
调节对象pH 值控制系统是一个以其可变增益著称的成分控制系统。
如图描述了一条典型的曲线,这是pH 值相对于所加的酸液与流入液体流量之比值的关系曲线。横坐标是一个比值,它表明过程的增益,即单位酸液流量所引起的pH 值变化, 随着要处理的流入液体的流量而变化。当被调参数出现偏差时,调节器对于偏差e作出的响应,应该是其输出量的变化Δm恰好把偏差减小到零。要完成这项任务所需要前调节器增益与过程增益成反比,过程增益可以定义为偏差与消除这个偏差所需的m 的变化量之比值
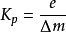
Kp可用曲线上连接偏差为e和偏差为0这两个点的直线的斜率来表示,如图所示。只有在控制点上,pH 曲线的斜率才与该点构过程增益相等。在其它点上,曲线的斜率要比该点的过程增益Kp小稃多,可见pH 值控制系统是一个典型的可变增益系统。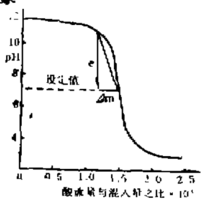
执行机构调节阀是调节系统中非常重要的一个环节, 因为它处于最终执行调节任务的地位,调节阀选择的好坏,对系统是否能够很好起调节作用关系甚大。选调节阀首先要使其流通能力满足生产要求, 其次要估计调节阀在管线上的阻力降分配比,要使阀在全开情况下占有整个管线阻力降的较大比 ,这是调节阁能否起调节作用的关键。如果流经调节阔的阻力降所占的比倒较小,将使调节阀的工作特性发生畸变。而调节阀的流量特性的非线性特性, 可作为过程非线性的一种补偿手段。2
常见pH自动控制系统阈值控制市售的最常见的pH自动控制系统,提供了两个由使用者设置的阈值。例如pH=6和pH=9。当测得的pH值小于6时,碱加药机开;pH大于6时,碱加药机关;当测得的pH值大于9时酸加药机开,小于9时酸加药机关。这类简单的自动控制系统一般不能对pH值实行有效的控制,相反会造成系统pH值强烈的震荡。3
反馈控制常规的反馈控制系统采用偏差值(ΔpH)经过各种不同类型的控制规律的运算后,作为控制的输出。当输出与偏差之间成非线性关系时,控制系统需要加以非线性补偿。但是,一般非线性补偿只有在一定的范围内才有效。当输出与偏差间的非线性过于强烈时,一般的控制系统是无法胜任的。图是文献报道的一个pH值控制过程的真实记录曲线。该过程设定的pH值是7.5。使用石灰作为碱添加剂,硫酸作为酸添加剂,由一个常规调节器组成的调节系统。控制系统输出的记录曲线显示出系统的pH值强烈震荡。3
pH控制过程的特征中和滴定曲线被处理水水质的pH定量特征常用其中和滴定曲线来表征。如图是一实测的中和滴定曲线。水样取自一染化厂的废水。图中的横坐标为添加的中和剂(此处为0.1molNaOH)的体积毫升数,纵坐标为pH值。废水初始的pH值为0.69,中和到接近pH=7时,添加的NaOH总量为280.5毫升。
非线性由图可见,中和滴定曲线呈S型。曲线在低pH值范围变化缓慢,添加中和剂总量的95%时,即267毫升的NaOH,仅仅使pH值由0.69上升到2.5左右。而在pH=7附近,曲线变化非常陡峭,添加中和剂总量的1%,即2.8毫升的NaOH,即可使pH值由pH=5.7上升到pH=9.8。
用缓冲指数(BufferIndex:σ=ΔpH/Δφ)定量地表征水样的pH特征。由图可见,在pH=7附近时,σ=1.46(mL/1)。而在低pH值范围时,σ=0.007(mL/1)。缓冲指数的急剧变化,即pH值变化的强烈的非线性,是pH控制问题中最显著的一项特征,也是造成pH控制困难的一个重要原因。
在上述染化厂废水的例子中,如果需要将废水的口H控制在6到9之间,则添加剂的误差不能超过中和剂总量的0.5%。当废水初始的pH值更低时,控制的精度要求更高。综上所述,pH值控制问题具有基本特征是:强烈的非线性;离子浓度(H离子或oH离子)的变化范围大,从而所需添加的中和剂量的变化范围可以达到几个数量级;为了将pH值控制在允许范围以内,要求非常高的控制精度。正是这些特征,使得pH的控制问题成为工程控制中最困难的问题之一。3
平衡迟缓和震荡平衡迟缓指的是系统加入扰动后,达到平衡需要的时间。当过程需要连续控制时,平衡迟缓给控制带来了很大困难,常常导致系统震荡。是一个实验系统pH值随时间变化的记录曲线。在t=t0时刻,由酸液注入装置向系统加入酸液,系统的pH值开始下降。在t=tm时,酸液扩散至pH计的探头,测得pH的极小值。但直到t=tb时刻,新加入的酸液才和整个系统均匀混合,达到新的稳定值。显然,如果系统在达到稳定之前,例如根据在t=tm口时刻测得的pH值作出反应,则会过量添加中和剂,造成系统控制品质的下降。系统达到平衡需要的时间取决于系统的组成、液体的流速、搅拌的效率、加药机和pH探头的安装的位置以及中和反应速度等多种因素。3




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国