北京时间10月2日下午5点30分,2017年诺贝尔生理学或医学奖揭晓,3位美国科学家杰弗里.霍尔(Jeffrey C. Hall), 迈克尔.罗斯巴什(Michael Rosbash)和迈克尔.杨(Michael W. Young)获奖。获奖理由是“发现了调控昼夜节律的分子机制”,就是表彰三人对于生物钟机制的研究,他们的发现成功解释了植物、动物和人类是如何适应自身的生物节律并与地球的转动保持同步。3人将均分900万瑞典克朗奖金。
在今年诺贝尔生理学或医学奖揭晓之后,包括美女教授颜宁都高呼意外,因为该研究“是毫无争议的一个奖,以至于都忘了还没得”。
的确,在今年的诺贝尔生理学或医学奖揭晓之前,此项研究并不属于夺奖大热,以至于第一时间,科研编辑们都在重新编写获奖稿件。
到目前为止,几乎所有获得诺贝尔生理学医学奖的研究,从发现理论到变成一个较为成熟的研究领域,都跨越了20到30年。包括今年的获奖成果,也是从上世纪90年代初开始的。2012年的诱导性多能干细胞(ips细胞)属于为数不多的例外,从2006年第一篇论文发表到摘取桂冠,仅仅花费了6年时间。
作为科学界一年一度的狂欢,预测获得该奖项的研究和获奖者是不少科研工作者的乐趣之一。其实在各个版本的诺奖预测中,预测谁通过什么研究有可能问鼎并不难,但具体到在哪一年夺下桂冠,是独占鳌头还是分享奖金才是真的有难度。
随着科技的不断进步,诺奖级别的研究不断增加,热门人选早已排起长队,所以,想要获奖还需要科学家们足够长寿啊。
那么,接下来我们就为大家简单盘点一下近些年生物学界诺奖级别的成果。这些研究与发现在当下科研圈里都拥有足够的热度,无数科学家投身其中。
这些看似高深到与日常生活丝毫不沾边的科学研究,的确很难用一两句话解释清楚,但它们在未来不仅仅有可能问鼎全球最高的科研荣誉,同时也是人类对于未知世界的不断探寻与深入理解。
- 大热的基因编辑技术CRISPR
今年几乎所有的夺奖预测里都有基因编辑技术CRISPR,但最终与2017年诺奖擦肩也并不会让大家感到意外。
在2012年和2013年,CRISPR是科学杂志年度突破的第二名,并且在2015年,它成为该奖项的赢家。

同时,CRISPR在2014年和2016年被麻省理工科技评论评为10项突破技术之一。太过于年轻的CRISPR,大概还没有排到诺贝尔奖的号码牌。
基因编辑技术是指对DNA核苷酸序列进行删除和插入等操作,CRISPR/Cas9是该编辑系统之一,也是目前发展研究进行的最深入的技术。CRISPR/Cas9是继锌指核酸内切酶”、“类转录激活因子效应物核酸酶”之后出现的第三代“基因组定点编辑技术”。凭借着成本低廉,操作方便,效率高等优点,CRISPR/Cas9系统迅速风靡全球的实验室,成为了生物科研者的有力帮手并有望成为未来疾病基因治疗的有效选择之一。
CRISPR是Clustered Regularly Interspaced Short Palindromic Repeats的缩写,是大多数细菌及古细菌中的一种获得性免疫方式,类似我们人类的获得性免疫系统。当细菌受到被噬菌体感染和杀死的危险的威胁时,细菌CRISPR系统会分解入侵的DNA(即噬菌体DNA),并将具有特定碱基序列的片段(原间隔序列)掺入细菌本身的基因组中。
细菌在与其天敌——噬菌体的长期斗争中,不断收集和存储每种类型的噬菌体病毒特异性DNA碱基序列。当已经记录的病毒再次入侵细菌时,通过从病毒库DNA复制的拷贝(RNA)与入侵病毒的DNA相匹配即可快速发现病毒。之后由该RNA引导的酶Cas蛋白切断病毒DNA,使病毒失去复制繁衍的能力,以此来抵御外界病毒入侵。
--------------太长不想看之好莱坞大片版本------------------
当细菌们遇到病毒入侵的时候,它们的体内会被注入病毒的DNA。因此,一旦被入侵,细菌就会想尽办法消灭敌人。这时候,细菌们会像好莱坞大片电影里的特工一样,快速地在自己的数据库中识别出通缉犯特征——也就是病毒DNA,并把这个通缉犯的信息输入到一个导航系统(RNA)里;同时,细菌还会派出一位杀手:一个胖胖的名叫Cas9的蛋白质,让它在第一时间带着导航去抓通缉犯,并把通缉犯也就是病毒DNA,无情地一刀剪断。这样,细菌的小命就保住了。
----------------------------------------------------------
以上,就是CRISPR/Cas9系统在自然界的工作原理。
科学家们发现了自然界中这一自古存在的独特系统,并将其作为工具来对物种的基因进行编辑。RNA好比一位资深老司机,安全行车不跑偏,Cas9蛋白这位行走江湖多年的冷血杀手,一旦被老司机送达指定位置,就不会让编辑目标逃脱它的魔剪。
如今,基因编辑已经在短短数年间从尖端实验室走入了中学课堂,难怪CRISPR/Cas9出现后,学术界要给予其“上帝的剪刀”这样意味深长的雅号。
- 癌症免疫治疗新星,钱途一片大好的PD-1
同样年轻的PD-1,是笔者最看好的生物医药未来的科研方向之一,与CRISPR系统不同之处在于,它已经进入癌症的临床治疗。
就在不久前,创新药“重组抗PD-1人源化单克隆抗体注射液”获得美国食品药品监督管理局(FDA)批准,开展用于实体瘤的临床试验。截止目前,全球仅有两款PD-1 单抗获批上市,分别是BMS 的Opdivo(2014 年获批)和默沙东的Keytruda(2014 年获批)。2016 年,Opdivo 实现收入37.74 亿美元、Keytruda 实现收入14.02 亿美元。
那么,钱途一片大好的PD-1到底是什么呢?
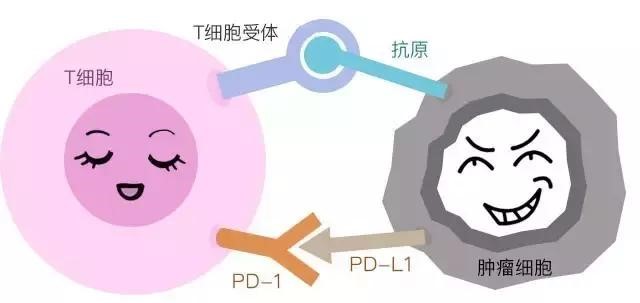
PD-1全名叫做程序性细胞死亡蛋白-1,是一种重要的免疫抑制分子。以PD-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。其配体PD-L1也可作为靶点,相应的抗体也可以起到相同的作用。
正常情况下,PD-1存在于人体的杀伤性T细胞表面,PD-L1则位于正常组织细胞表面,两者关系如同锁孔与钥匙,相互扣成一环。当PD-1和PD-L1呈嵌合状态时,T细胞功能被封闭,作用得不到发挥。这样组织细胞能免受杀伤性T细胞攻击、受到保护。
但不幸的是,肿瘤细胞逃避T细胞摧毁的一种途径是通过在它表面产生PD-L1,当免疫细胞T细胞表面的PD-1识别PD-L1后,可以传导抑制行信号,T细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号。
到目前为止,抗PD-1单抗药品已经获批用于黑色素瘤、非小细胞肺癌、头颈部鳞癌、经典型霍奇金淋巴瘤、尿路上皮癌、肾细胞癌、或少数实体瘤比如肝癌和胃癌。
- 微量级的夺奖热点-micro RNA (miRNA)
1993年生物学家报告了第一例miRNA,line4并发表在了细胞期刊上,最初被认为是线虫所独有而未能引起广泛关注。随后其它科研团队在自然杂志上报告了第2个miRNA,let7,由于它在数个不同的动物中有同源RNA,因此逐渐引起关注。
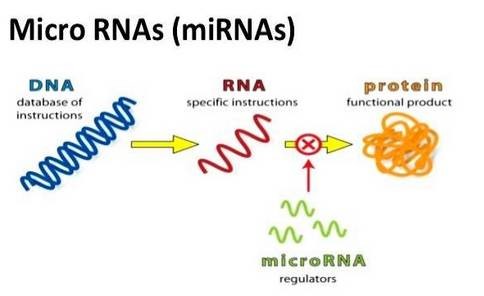
miRNA是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,其大小长约20-25个核苷酸。成熟的miRNAs是由较长的初级转录物经过一系列核酸酶的剪切加工而产生的,随后组装进RNA诱导的沉默复合体,通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译。
研究表明miRNA参与细胞内各种各样的调节途径,包括发育、病毒防御、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢等等。最近的研究同时发现,miRNA表达与多种癌症相关,这些miRNAs所起的作用类似于抑癌基因和癌基因的功能。
- 经典中的经典之PI3K信号通路
PI3K是英文phosphatidylinositol-3-kinase(磷脂酰肌醇-3-激酶)的缩写。
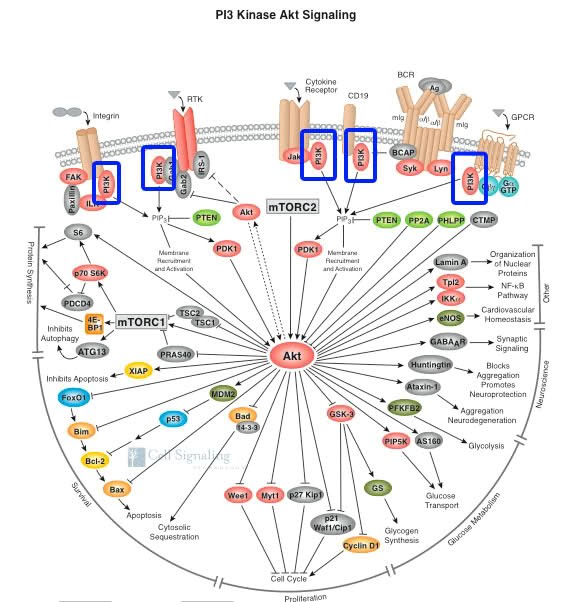
PI13K通路已经被证明了与糖尿病的发展有关,同时它也是一种经典的癌细胞驱动因子,连接着生长因子信号和下游的很多信号通路,比如细胞增殖、细胞代谢和细胞存活等。几乎在人类的每一种癌细胞中,许多研究发现在多种类型的人类癌症中都存在PI3K异常,因此PI3K可以作为一个经典的抗癌药物的关键靶点。
目前,针对PI3K的几种抑制剂已经被陆续开发出来并且有些已经通过了临床测试。但以现阶段的结果汇总来看,PI3K抑制剂药物在临床应用方面效果并不理想,对于提高癌症病人生存率并无显著效果。
最近,来自美国wistar研究所的科学家们进行了一项新的研究,他们发现单独使用PI3K抑制剂进行癌症治疗可能会促进肿瘤细胞的侵袭性以及向其他器官的扩散,进而导致病人病情恶化。近日,该项研究的相关研究成果发表在国际学术期刊PNAS上。
- 免疫治疗的下一个瞩目对象——调节性T细胞
调节性T细胞(Treg)是一群具有负调节机体免疫反应的淋巴细胞,通常起着维持自身耐受和避免免疫反应过渡损伤机体的重要作用,但也参与肿瘤细胞逃避机体免疫监视和慢性感染。
最早也曾被命名为抑制T细胞,因缺乏明确的表面标志,研究长期处于尴尬和停顿的境地。调节性T细胞最重要的分子标记是一种转录因子Foxp3,在所有调节性T细胞中均可发现有多量表现。
在控制免疫耐受和免疫响应方面的关键作用使得调节性T细胞成为了多种疾病的潜在治疗靶点,包括自身免疫性疾病、移植物抗宿主病和癌症。
- 一眼过去看不懂讲什么的表观遗传学
表观遗传学是生命科学的热门领域之一,每年科研工作者贡献无数篇探讨各种疾病与之相关的论文,如果表现遗传学最终获奖,由哪几位科学家来分享奖金定会让评审们十分头疼。
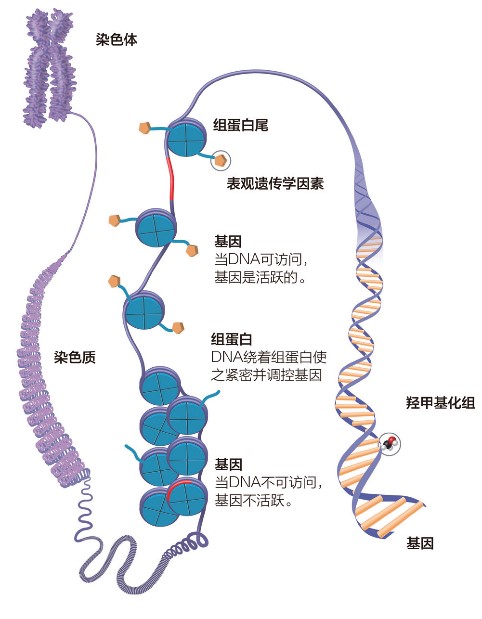
我们都知道生物的外在性状是由其DNA序列所决定的。然而,表观遗传学的研究结果发现,生物的遗传性状还可以被DNA序列以外的因素决定,即便具有相同的DNA序列,性状的表观差异仍然可能存在并向后代遗传。
表观遗传的现象很多,目前已知的有DNA甲基化,基因组印记,母体效应,基因沉默,核仁显性,休眠转座子激活和RNA编辑等。
上述这六个热点,无论是最基础研究的PI3K信号通路,表观遗传学又或者是偏向于应用的基因编辑技术CRISPR以及micro RNA,还是未来个人化治疗的新角色PD-1和调节性T细胞,都是未来某一天非常有可能出现在诺贝尔奖获奖名单上的。
后记:
在写这篇文章时,笔者选取了很多当今生物科研界的热门研究,并最后选择了这六个热点,细心的读者应该有所发现,笔者只列举出了热点,但没有写出获奖热门人选,这是因为每一个科研成果,都是无数科研工作者辛苦的工作所累积出来的。一个成熟的理论,一个诺贝尔奖级别的研究,从无到有需要许许多多论文来一点点论证探讨的,这些在舞台背后的科研工作者,最后谁能站到前台,享受鲜花荣誉和掌声,还是交给神秘的诺贝尔奖评审们来商量思考吧。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国