白色碎冰上的猪肝,看上去也许和屠宰场猪肝没有两样,不过这却不是普通的猪肝,它取自一种基因修饰的小型猪,医生将要把它移植到藏酋猴体内(一种生长于中国四川的灵长类动物)。
就在3小时前,西京医院器官移植外科医生从造价高昂的转基因猪身上将猪肝摘取下来。助手将猪肝脏交给术者,经过5个小时的脾脏切除,血管吻合等十分精细的操作,藏酋猴体内的血液灌注于猪肝脏内,肝脏由土黄色逐渐变为鲜红色,引流管内流出了金黄色的胆汁。按照设想,猪肝脏将会在藏酋猴体内存活并逐渐开始发挥功能。这个耗资近10万元的手术仅仅是为该项研究新增了一例样本。
这项大型研究项目是由中国科技部“973计划”(国家重点基础研究发展计划)支撑的旨在利用基因工程技术探索解决人类器官来源的问题,简单说来就是用改良的猪器官替代人类器官从而挽救患者生命。
异种移植何时能够应用于临床治疗?课题负责人之一陶开山教授说:“大概还需要3年时间的研究和实验,才有可能将异种移植术应用于暴发性肝衰竭临床治疗,帮助患者渡过生命危险期。而使用基因猪的肝脏永久来取代人的肝脏,则需要更多时间的探索。”
一、为何要采取异种器官移植
器官移植是20世纪医学领域的一项重大突破,挽救了无数器官衰竭患者的生命。然而数十年以来,器官资源的短缺一直是移植手术绕不开的话题。即使在器官捐献率较高的美国,每10分钟就会新增一名需要进行器官移植的患者,平均每天亦有22位病人在等待器官移植中死去。可供移植的器官短缺不仅使得人们难以负担等待过程中的治疗费用,由此衍生的黑市交易也带来了更多的社会问题。
供体来源短缺极大困扰着外科医生,加之近年来中国取缔了司法来源的器官供体,使得供体短缺的情况更加严重。各国政府及医院机构采取多种途径试图拓宽供体来源,包括立法“脑死亡”,改进肝移植的手术方式,如劈裂式肝移植,提高供体的利用效率等等,仍然不足以改善器官短缺的状况。供体短缺成为制约器官移植的瓶颈。
异体移植、3D打印、组织工程等都是替代同体移植的方法。3D打印技术造价比较高,而且只能打印细胞结构相对单纯的器官,比如血管。而对于肝脏、心脏等内部结构复杂的器官,3D打印很难实现,组织工程器官同样面临功能问题。因而就人类内脏器官复杂性而言,异体移植无疑是最“靠谱”的方法。
生物学家一直致力于寻找移植用器官的替代资源,人体捐献的器官不够用,用其他动物的怎么样呢?异种移植的问题由此被提出。备选方案中你可能马上会想到非人灵长类。可惜这些人类近亲们或是已经濒危,或是器官大小与人类相距太远。最终生物学家认为理想的器官供体应该源自一种经过长期驯化的动物,而它们的器官又恰好要与人体器官体积相似。在众多动物中,家猪脱颖而出了。
二、异种移植的发展
1.早期探索阶段
世界上第一例异种器官移植手术发生在1905年。当时,法国医生布兰斯多将兔肾切成薄片植入肾功能衰竭儿童体内,手术很成功。但16天后,儿童死于排斥反应引发的肺部感染。后来在狗,兔,猪等不同动物之间的研究,逐渐发现跨物种的移植存在致命性的排斥反应。由于无法控制这种排斥反应,异种移植研究由此进入冰点。
直到1960年,希钦斯和埃利昂两位科学家分离出一种强有力的免疫抑制剂“硫唑嘌呤”,二人也由此获得1988年的诺贝尔奖。1964年,美国Reemtsma医生,完成第一例成功的异种肾移植(黑猩猩-人)临床尝试,使用免疫抑制后受体最长存活9个月。这次实验重新燃起了医学界对于异种移植的希望。此后陆续进行了包括异种心脏移植,异种肝脏移植等。
然而60年代后期,由于血液透析技术的发展,以及脑死亡立法在各国的通过,这使得异种移植关注度逐渐降低。70年代后期,艾滋病的发生使人们意识到种间感染的危险性,这也使得人们对于异种移植态度更为谨慎。异种移植的研究再次陷入低谷。
20世纪90年代,由于同种移植技术的不断发展,使得供体短缺的情况日渐严峻。科学家将供体目标再次锁定在猪。1993年,匹兹堡大学北美器官移植中心David Cooper和同事发现,在猪器官移植以后几分钟内,人类免疫系统会启动免疫排斥反应,免疫系统攻击对象是一种存在于猪及其他非灵长类动物细胞表面的糖α-1,3-半乳糖(α-gal)。人和非人灵长类动物体内存在针对α-gal的抗体,抗原抗体结合后在数小时内即可引发超急性排斥反应,而这正是引起器官排斥反应的启动因素。
α-1,3-半乳糖(α-gal)苷转移酶是产生这种糖必须的酶,理论上抑制这种酶或敲除这种酶的基因就可以避免排斥反应。受限于基因编辑技术,早期主要是通过药物抑制α-gal的产生并在移植前吸附血液内的抗体,但是免疫系统仍有不同程度的激活,且抗体水平会随着移植物的存活时间延长而增加。直到2003年,Revivicor公司创始人Ayares和他的同事创造了第一个敲除α-gal的克隆转基因猪(GTKO猪),异种移植进入一个崭新的发展阶段。
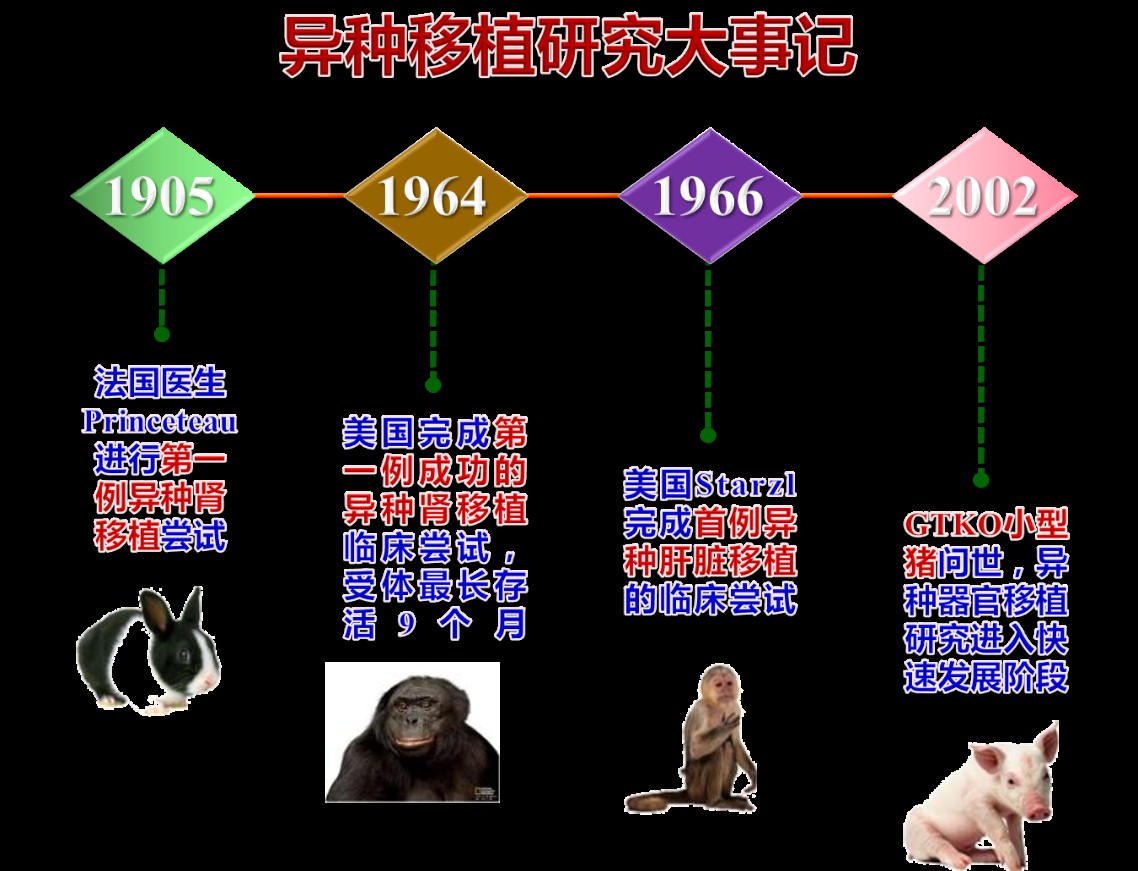
2.GTKO猪:异种移植新的里程碑
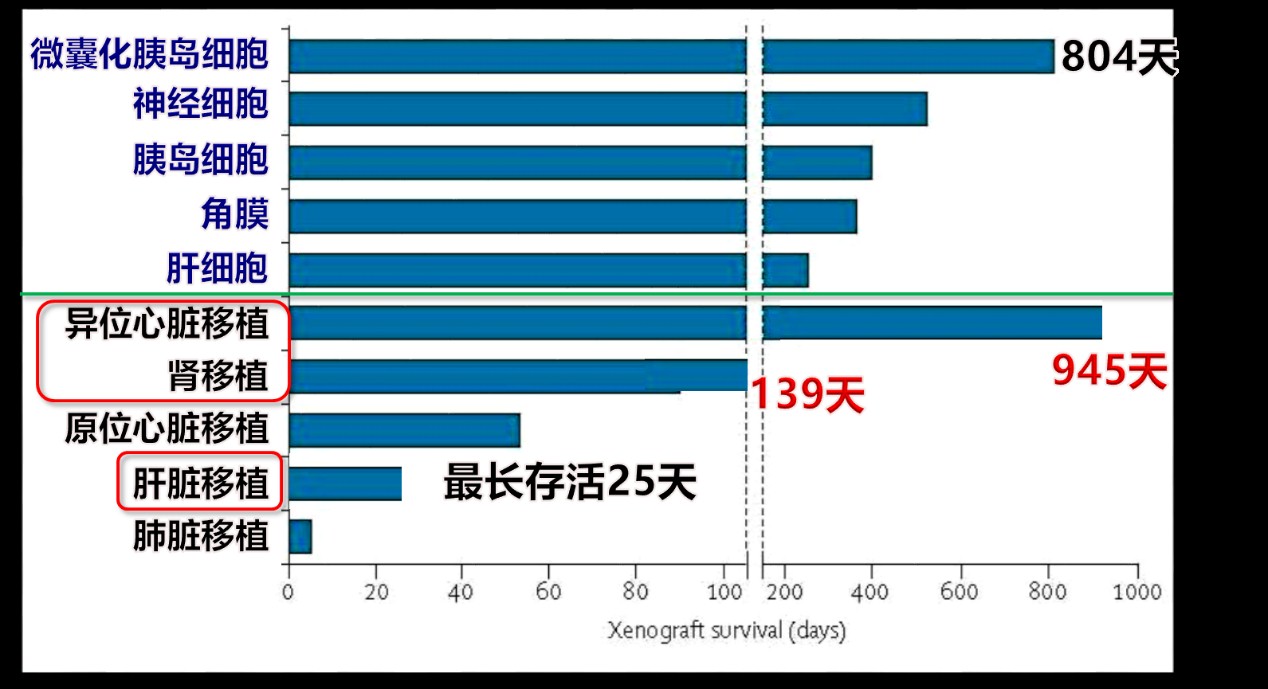
随着GTKO猪的问世,移植界对于异种器官移植的热情迅速被点燃。目前美国,中国,日本,韩国和澳大利亚等均已有异种移植的工作团队。异种移植领域的纪录一次又一次被刷新。至今异种心脏移植的受体存活时间已达945天(美国,麻省总院),异种肝脏移植受体存活时间则相对较短(14天,中国,西京医院和28天,美国,麻省总院)。相对于实体器官移植,异种细胞和组织移植的存活时间明显较长,主要是由于异种细胞和组织缺乏血管,免疫排斥反应较轻。2012年,匹兹堡Starzl 移植研究所的David Cooper等人在Lancet 上撰文,并预言“异种移植将会是下一场医学革命”。
三、异种移植面临的问题
虽然借助于基因修饰技术,异种移植取得了巨大的进步,但是若要将其应用于临床,目前看来仍然面临诸多亟待解决的问题。
1.供体选择的问题
虽然非人灵长类动物与人类的亲缘关系更为靠近,但是由于非人灵长类动物每胎产仔少,成熟周期长,数量有限,不能满足大量的研究和移植需求。相比之下,猪的生长周期短,易于饲养繁殖和进行基因改造,降低了研究成本。猪的器官在大小、结构等解剖学指标和生理学指标上,也与人体的器官大体接近。所以,选择猪用于异种器官移植,已成为国际上的共识。


- 排斥反应
猪-人的异种移植面临超急性排斥、急性排斥以及慢性排斥的问题。
(1)超急性排斥反应(HAR)由灵长类动物体内预存的天然抗体与猪内皮细胞表面α-1,3-Gal抗原结合,导致血栓形成。2003年,美国Ayares研究团队培育出α-1, 3-半乳糖苷转移酶基因敲除猪(GTKO猪),基本上解决了超急性排斥反应。
(2)急性排斥反应(AR)主要是由灵长类动物体内的免疫细胞攻击植物引起的排斥反应,而目前的研究表明在异种移植中急性排斥主要是以补体介导的细胞毒作用和巨噬细胞、NK细胞介导的固有免疫为主,这与同种移植过程中急性排斥中以T淋巴细胞和B淋巴细胞为主要效应细胞的反应模式并不相同。固有免疫是机体在种系发生和进化过程中逐渐形成的一种天然免疫防御功能,具有识别广泛抗原的能力。异种抗原的刺激是导致固有免疫系统激活的主要原因。
目前由于转基因技术的发展,可以对GTKO猪进行人源化的基因修饰,如转人源CD55,CD46等补体调节蛋白,转人源CTLA4Ig或 LEA29Y、PD-L1 等免疫调节基因,抑制T细胞反应,转人源CD47、HLA-G 或 HLA-E,抑制NK和巨噬细胞的固有免疫反应,目前已经可以制备同时含有6个基因修饰的GTKO猪。
(3)慢性排斥反应(CR)主要是以T细胞介导的细胞排斥为主,哈佛大学王日健教授研发的抗CD40抗体2C-10能显著延长异种心脏存活时间,使得异种心脏移植延长至945天。此外日本中内启光教授课题组利用IPS细胞结合嵌合胚胎技术试图在猪体内培养出人体器官,目前该课题组已经成功在猪体内制备出不同基因型的猪胰腺脏器。

转人源CD47基因修饰猪
3.凝血机制的改变
异种移植后,会明显触发机体的凝血机制导致凝血功能异常。而这一点在异种肝脏移植中表现的尤为突出,在移植的早期,受体体内的血小板数量呈现出明显下降。血小板是机体凝血系统的“卫兵”,一旦低于限值,机体就会出现不可控的出血。因而血小板的减少及凝血功能的失调,成为制约异种肝脏移植的桎梏。目前有研究团队通过转入人源化的凝血调节分子以及敲除ASGR1(一种介导血小板吞噬分子受体)以纠正异种移植后的凝血紊乱。
- 生物安全性
在异种移植中,跨物种的生物安全问题一直引人注意。众所周知,很多人类病原体都来源于动物,例如HIV来源于狒狒, SARS来源于果子狸,而令人闻之色变的埃博拉病毒则来源于果蝠。通常认为,种属上与人越接近的物种,其所携带的病原体就越容易感染人类。以猪为供体的异种移植是否存在种属交叉感染的风险,仍无定论。
目前的研究确定了26种存在种间交叉感染风险的病原体。其中,细菌和部分病毒可以通过培育SPF的猪来解决。目前关注最多的是猪逆转录病毒(PERV)。猪逆转录病毒又分为A型、B型和C型。虽然在异种胰岛移植的临床观察中并未发现PERV的感染,但是由于体外实验中证实PERV可以从猪的细胞中转入人体细胞,并整合至人类基因中,因此存在一定的风险。
要消灭PERV,可以针对它的一个关键基因pol。这个基因编码是一种逆转录酶,让病毒能够整合到其他物种的基因组里。而这个狡猾的基因在猪的肾上皮细胞里,足足留了62套备份。要挨个消灭它们,太麻烦了。生物技术的发展再次让这个难题迎刃而解,2015年10月,杨璐菡博士利用一种新的基因编辑技术-CRISPR/Cas9 一次性的敲除了隐藏着猪基因组中的62个PERV片段,体外实验验证病毒的感染率被削弱了近1000倍,该结果发表在《Science》杂志。异种移植的临床应用只差临门一脚。

生物安全性
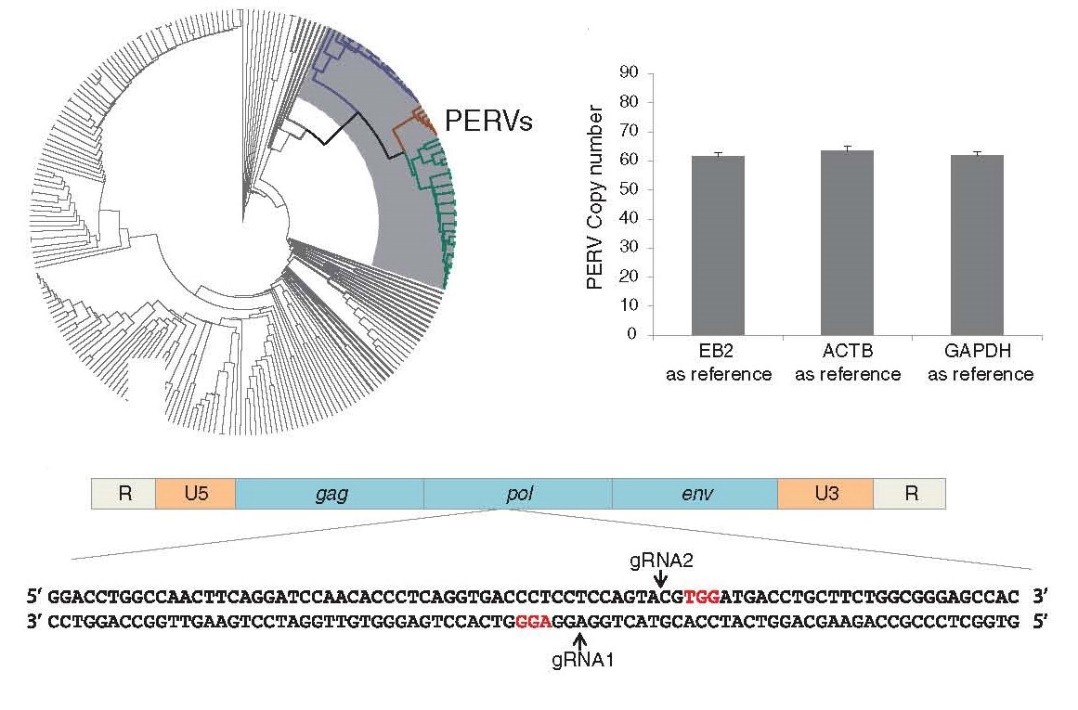
科学杂志报道:利用CRISPR/Cas9编辑猪PERVs
5.伦理争议
目前因文化传统、宗教信仰、价值观念的不同对异种移植移植存在争论。2013年在德国慕尼黑召开了关于异种移植伦理探讨的会议。会议中各个宗教各自阐述了对异种移植的看法,其中犹太教核心教义是人的生命高于一切宗教制约,在病危情况下,应该而且必须接受移植;基督教伦理认为,只要遵守道德规定,不虐待动物就可进行异种研究。可允许病人因治疗疾病的目的而接受异种动物器官;伊斯兰教认为,人是在生物链的顶端,人身天授,人有义务去保护好自己的健康。因此,伊斯兰教的观点中用异种移植进行治疗是可行的。因此只要在人权和自主权不被影响的条件下,有责任地对待动物而不是简单的将其当做工具,宗教伦理是不会禁止异种移植的。
四、异种肝脏移植:治疗临床爆发性肝衰的极具潜力的手段
肝脏是身体内以代谢功能为主的器官,并在身体里面扮演着去毒素,储存糖原(肝糖),分泌性蛋白质合成等等功能。目前仍无十分有效的体外人工肝脏用以替代肝脏的功能,因此在当前先进的辅助技术支持下,人可以“一日无心”,“一日无肾”但却不能“一日无肝”。
临床上有一类患者,由于药物或是病毒感染导致肝脏短期内失去功能,称之为“爆发性肝衰”患者。这类患者的肝脏尚具有再生和修复的能力,仅仅需要在短期内辅助移植部分肝脏,用以维持肝脏的功能,即可使得患者度过危险期。但是由于供体的短缺,无法满足爆发性肝衰患者迫切的肝移植需要,使得爆发性肝衰的死亡率极高。
以窦科峰、陶开山为主的研究团队创造性使用GTKO猪—藏酋猴进行异种肝脏进行脾窝异位辅助性肝脏移植,旨在解决此问题。
在经过仔细对比和分析,最终课题组选择了藏酋猴作为移植受体,该灵长类动物的生理指标与人类极为接近,且体型较大,适合移植。应用该术式,课题组成功完成了4例GTKO猪-藏酋猴的异种肝脏移植试验,最长存活时间达到了14天(2013年),在当时为异种肝脏移植最长存活纪录。
正如文章开头所写,新的肝脏移植入藏酋猴体内,逐渐发挥了功能。通过生理生化指标的检测,藏酋猴体内开始出现猪源性的白蛋白及凝血因子,胆汁的持续流出同样证实了肝脏的合成功能开始恢复。通过CT影像学检测的方法,对新肝脏的体积进行了评估,评估结果表明,新肝脏的体积在术后出现了增大,这说明猪肝脏在藏酋猴体内出现了再生和修复。利用该模型课题组先后探讨了异种肝脏移植后凝血机制紊乱的机理和主要组织相容性抗原复合物MHC分子的不匹配问题在异种移植排斥中的作用,极大的推动了异种肝脏移植的发展。
道路依旧是曲折的,相较于其他脏器的异种移植,异种肝脏移植的存活时间仍然十分短,诸多难题尚待克服。然而前途却是光明的,异种肝脏移植一旦应用于临床,将会是肝脏衰竭患者的福音。正如肝移植之父Thomas E. Starzl所言:“任何技术在昨天看来可能是不可思议的,今天看来也仅仅是能勉强做到的,但是明天也许就会成为一种常规手段。”




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国