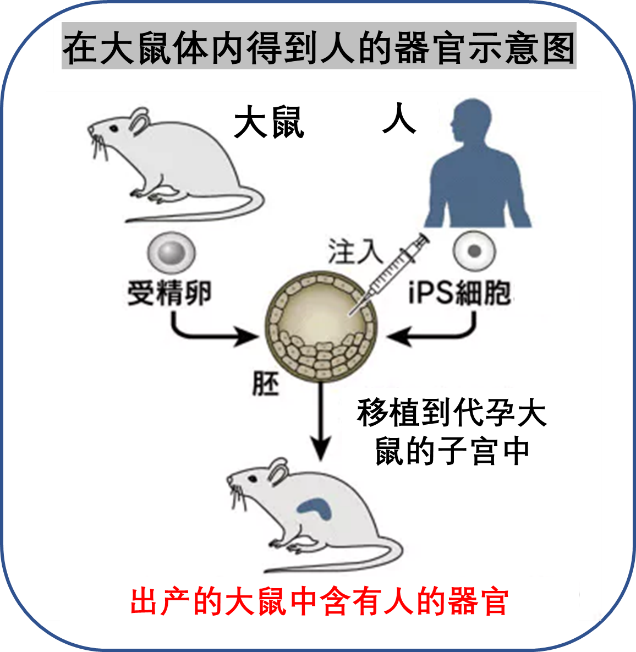
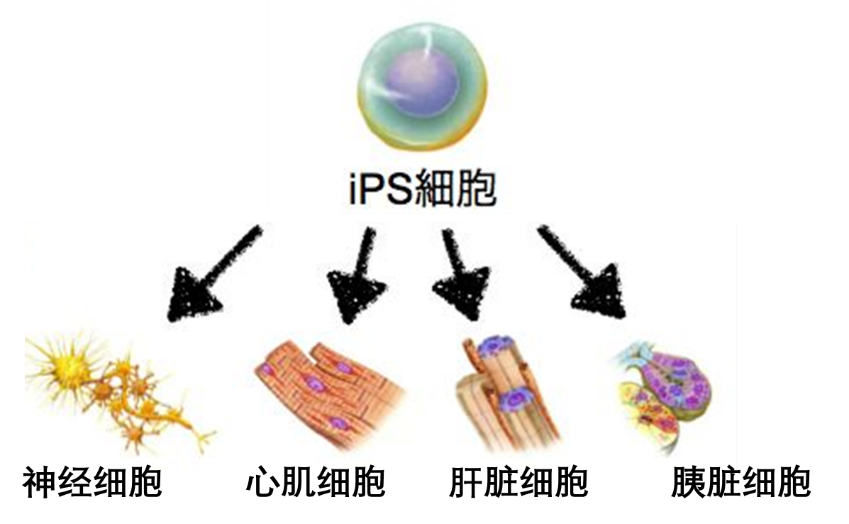
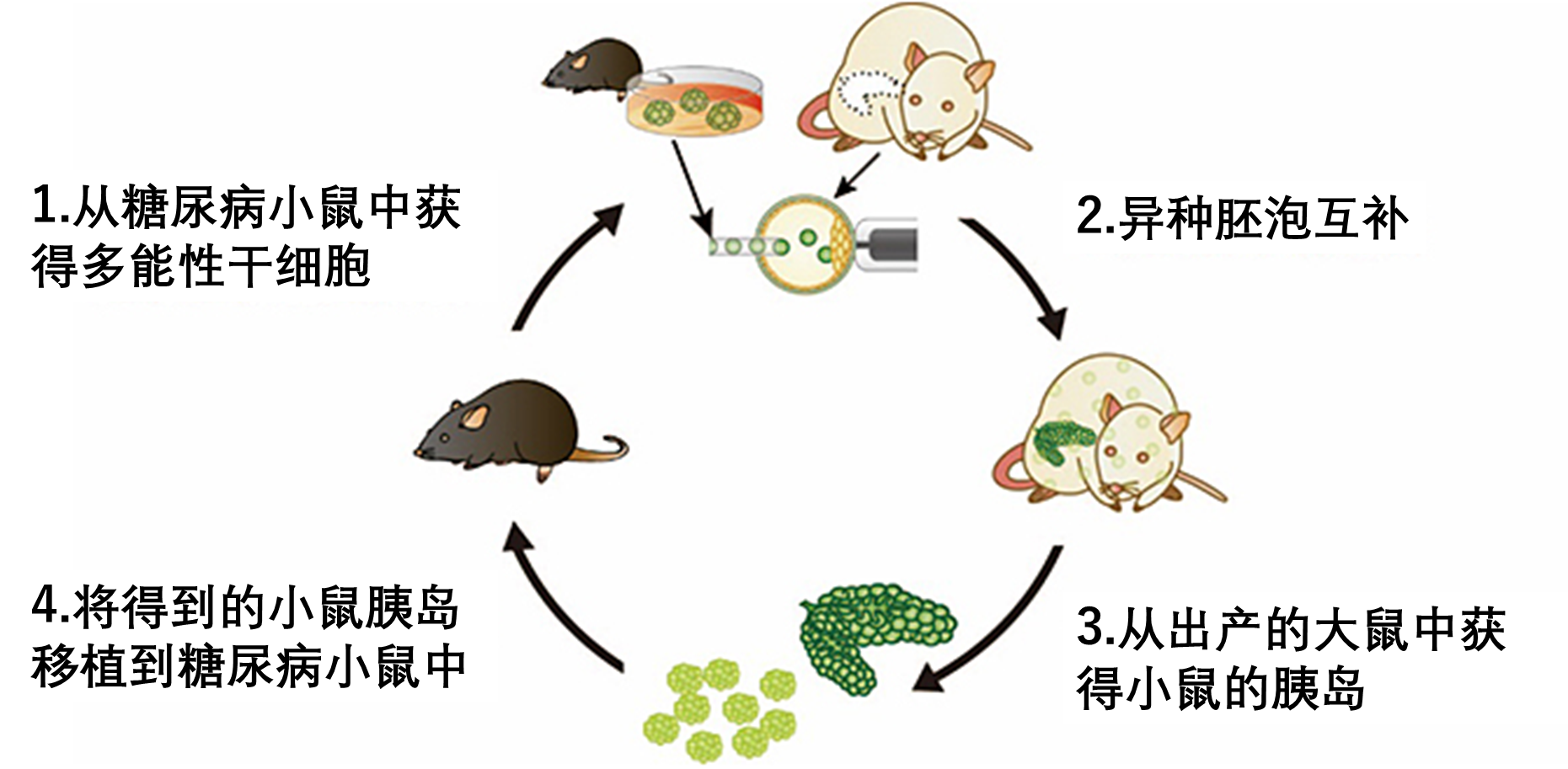
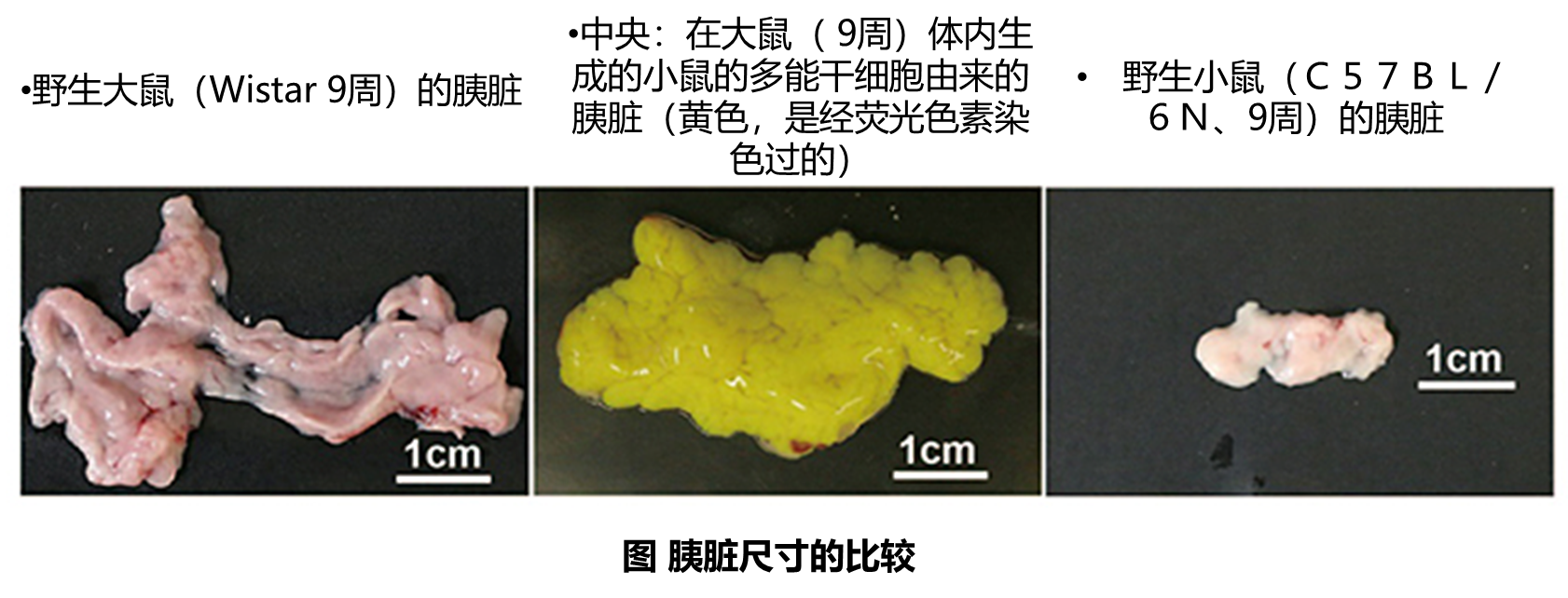
今年7月24日,日本文部省批准了东京大学关于“使用诱导性多能干细胞(Induced pluripotent stem cells,简称 iPS 细胞)在鼠科实验动物体内生成人体器官”的研究计划,该新闻一出,立即引起了轩然大波。日本各大主流媒体都对此进行了相关报道,《自然》杂志也发表了新闻评论文章。这项研究突破了以往科学界所设定的伦理界限,是全球首例人类-动物胚胎实验,因此得到了多方的关注。这到底是一项怎样的研究?进行此类研究有何用意?这项技术距离实际应用还有多远的距离?这篇文章将为大家揭示答案。





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国