概述
在免疫学中指补体激活后产生的膜攻击复合体。C5b6789n 复合物,即膜攻击复合物MAC。插入细胞膜的MAC通过破坏局部磷脂双层而形成“渗漏斑”,或形成穿膜的亲水性孔道,最终导致细胞崩解。
当机体感染病毒后,补体被激活,形成攻膜复合物(membrane attack complex,MAC),且破坏受感染的细胞。MAC在细胞膜上形成亲水性穿膜孔道,能使水和电解质通过,而不让蛋白质类大分子逸出,最终可因胞内渗透压改变,而使细胞溶解破坏。
电镜下观察,MAC为中空的C9聚合体,其穿越靶细胞脂质双层膜,形成内径约11nm的跨膜通道。该通道容许水、离子及可溶性小分子等跨膜自由流动,而胞内胶体渗透压较胞外高,故大量水分内流,导致胞内渗透压降低,细胞逐渐肿胀并最终破裂(即细胞“溶破”)。
形成过程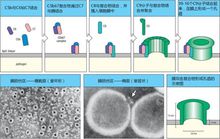 补体激活途径的末端途径中,C5b可与C6稳定结合为C5b6,后者自发与C7结合成C5b67,该复合物中的C7初步插入靶细胞膜脂质双分子层,继而C8于插入膜上的C5b67高亲和力结合,形成稳定的、深插入细胞膜的C5b678,该复合物可与12~18个C9分子结合为C5b6789n,此即攻膜复合体。
补体激活途径的末端途径中,C5b可与C6稳定结合为C5b6,后者自发与C7结合成C5b67,该复合物中的C7初步插入靶细胞膜脂质双分子层,继而C8于插入膜上的C5b67高亲和力结合,形成稳定的、深插入细胞膜的C5b678,该复合物可与12~18个C9分子结合为C5b6789n,此即攻膜复合体。
作用机制细胞的溶破作用补体对细胞的溶破作用主要是在MAC 的装配过程中,C5b-7 与C5b-8 已可插入细胞膜脂质双层,但不能形成孔道,对细胞的损伤不大。C5b-8 复合物结合上C9,并通过C9 分子的延伸,使更多的C9 分子结合形成管状MAC ,然后将靶细胞溶解。研究表明,MAC 中C9 分子的多少决定了细胞膜孔道的大小。补体对细胞的溶破作用在一定程度上呈现种属特异性。当补体和靶细胞来自同一种属时,补体溶解靶细胞的效率很低。这一现象称为补体溶细胞的同源限制。同源限制与细胞表面的糖蛋白有关。这些糖蛋白可干扰补体活化的限速步骤,直接影响C5b-9 复合物组装而发挥作用。1
促细胞因子产生当沉积于细胞表面的MAC ,插入细胞膜导致细胞膜通透性增加,细胞内外离子活动改变,激活细胞内信号传导过程,致产生多种生物活性物质,包括氧自由基、类脂质等炎性介质,并产生多种细胞因子,诱导膜蛋白表达等。这些效应对加强病原菌清除,促进局部组织增生修复有积极的作用,同时也可放大炎症反应,加重局部病变。2
MAC 的细胞非致死效应近年来通过对MAC 与有核细胞相互作用的研究,除了MAC 对靶细胞的溶破作用外,研究显示,有核细胞通过囊泡化或胞吞作用,清除沉积于细胞膜上的MAC,保护自身免受补体溶破。3
促内皮细胞凋亡Hughes 等研究MAC 在实验性肾小球肾炎中的作用,发现具有补体沉积的内皮细胞凋亡明显加剧,而且依赖于MAC,而用眼镜蛇毒液因子消除补体后,可明显减轻内皮细胞凋亡,可降低10 ~ 12 倍。CD59 是细胞的膜连接补体调节蛋白,可抑制C5b-9 的聚合和插入,给予抗CD59抗体抑制CD59 的作用后,可使内皮细胞凋亡加剧。同样用cDNA 去除补体的特异作用后,可保护内皮细胞免于损伤和肾功能受损。为进一步明确CD59 如何改善内皮细胞损伤,Nangaku等研究利用抗肾小球内皮细胞抗体致血栓性微血管病变,观察CD59 的作用,应用肾动脉灌注抗CD59 单克隆抗体,灌注抗CD59 并不影响介导血栓性微血管病变的抗内皮细胞IgG 的沉积,然而,在血栓性微血管病动物模型体内中和CD59后,导致C5b-9 在肾小球内大量形成。提示CD59 具有保护肾小球内皮损伤的作用。1
上调粘附分子表达当MAC 在内皮细胞形成后,胞浆内颗粒与胞膜融合后产生P-选择素(P-selectin)增加,随与循环中的中性粒细胞、血小板、单核细胞粘附作用增强,促炎性介质的释放。应用抗P-选择素单克隆抗体可阻断其上调作用。在缺乏免疫球蛋白的情况下,C5b-9 复合物本身可促进GEN P-选择素表达增加,并可上调E-选择素和ICAM-1,且呈剂量依赖型。另外,C5b-9 复合物还可协同TNF-α上调E-选择素,促进GEN 与中性粒细胞之间的粘附。4




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国