定义
包膜糖蛋白(Glycoprotein, GP)指由病毒自身编码的、包被在病毒外层的糖蛋白。GP是一种多功能蛋白质,在病毒的吸附和穿入宿主细胞、致病性、下调宿主细胞表面蛋白质表达和增加病毒装配和出芽过程中起着至关重要的作用;同时包膜糖蛋白是保护性免疫的主要目标,是诱导产生中和抗体的最理想抗原。
由于人类免疫缺陷病毒在感染宿主细胞的过程中,病毒首先要对宿主细胞进行识别、结合或者包膜与宿主细胞膜结合,这些过程都与包膜糖蛋白有关。
包膜糖蛋白通过与受体结合介导病毒进入宿主细胞,并可通过与内皮细胞结合破坏微血管的完整性,引起血管渗漏。另外,包膜糖蛋白具有重要的受体结合位点和抗原表位,在病毒感染和宿主免疫过程中起着十分重要的作用,也是目前疫苗研究的热点。
作用1、包膜糖蛋白是病毒的主要表面抗原,它们通过与细胞受体相互作用启动病毒感染发生,有些还介导病毒侵入宿主细胞。
2、包膜糖蛋白具有重要的受体结合位点和抗原表位,是目前疫苗研究的热点
3、包膜糖蛋白还可能具有凝集脊椎动物红血球细胞、细胞融合以及酶等活性。
HIV-1的包膜糖蛋白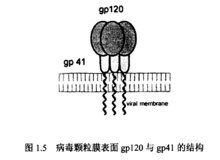 包膜糖蛋白介导的病毒与细胞的膜融合是HIV-1生命周期的开始,而病毒的进入并不是一件容易的事,HIV-1的包膜糖蛋白在病毒接触宿主细胞及膜融合过程具有决定性的作用。
包膜糖蛋白介导的病毒与细胞的膜融合是HIV-1生命周期的开始,而病毒的进入并不是一件容易的事,HIV-1的包膜糖蛋白在病毒接触宿主细胞及膜融合过程具有决定性的作用。
HIV-1的包膜糖蛋白是由基因env编码,在内质网上合成病毒包膜蛋白前体p88,经过糖基化修饰后成为gpl60前体,并折叠组装成多聚体形式,再被运输至高尔基体中,在宿主细胞蛋白酶的作用下剪切成为表面糖蛋白(surfaceglycoprotein, SU),相对分子质量约为1.2x105和跨膜糖蛋白(transmembraneglycoprotein, TM),相对分子质量约为4.1 x104,用分子量分别表示为gpl20(表面糖蛋白)和gp41(跨膜糖蛋白)。Gpl20及gp41通过细胞的分泌途径被转运到细胞膜表面,跨膜糖蛋白gp41插入到宿主细胞膜上,gpl20通过非共价键与gp41结合,形成细胞膜外的突起。成熟的病毒颗粒上gpl20与gp41的三聚体结构形成病毒包膜上的突起,并介导病毒在宿主细胞上的吸附和穿入。1病毒与宿主细胞的接触即为表面糖蛋白gpl20与宿主细胞表面的CD4受体结合,接着gpl20-CD4复合体与宿主细胞表面的辅助受体(一般情况下为CXCR4及CCR5)相互作用,使跨膜糖蛋白gp41发生构象变化,从而诱导膜融合,介导病毒进入宿主细胞内,引起感染。
Gpl20与gp41通过非共价键结合,在自然状态下,gpl20包含两个区域:1)内部区域,与gp41相互作用,并形成包膜糖蛋白三聚体突起;2)外部区域,形成病毒表面突起的大部分,并被高度糖基化修饰。Gp41单体包括胞外结构域(ectodomain, ED)、跨膜结构域(membrane spanning domainning, MSD)和胞内结构域(cytoplasmic domain, CD)三部分。
HCV的包膜糖蛋白丙型肝炎病毒(HCV)结构蛋白(C、E1和E2)在宿主内质网信号肽酶的作用下,裂解出E1和E2蛋白。HCV E1和E2蛋白高度糖基化,且每个糖基的羧基末端都有一个疏水区域,且依此锚定于细胞质膜。E1糖蛋白位于192~383位氨基酸序列,是一个约30~35kD的糖基化蛋白,含5~6个N一糖基化位点,脱糖基后为21kD,属于Ⅰ型内源性糖基化蛋白,E1通过N末端与Core蛋白结合,也可以与NS2蛋白相互作用,在病毒生命周期中起着重要的作用。E2糖蛋白位于384~809位氨基酸序列,含约11个糖基化位点,糖蛋白分子量为58~70kD。HCV E2蛋白,尤其是HVRl区是病毒基因组上最高变的区域,同时也是中和性抗体最重要的中和靶位,但有研究表明HVRl的删除对E2的结构并无明显影响,HVRl缺失的E2表型依然具有对构象敏感性单克隆抗体(MAbs)的结合活性,仍可与CD81的EC2区结构。在宿主信号肽酶的作用下,从HCV多聚蛋白的前体中裂解出来。E2蛋白由一个大的N端外膜区和一个C端疏水锚定区组成。疏水区仅有小于30个氨基酸的组成,作为跨膜区的一部分。新近研究发现其功能为:(1)膜区锚定;(2)形成E1-E2二聚体;(3)内质网定位;(4)包含信号序列。
E1和E2糖蛋白构成HCV的包膜蛋白,是病毒的重要组成部分,该包膜蛋白部分或全部位于病毒颗粒表面并含有重要的中和性抗原表位。El和E2通过非共价键形成异源性二聚体,共同组成HCV病毒粒子的包膜,其与病毒吸附和进入靶细胞过程有重要关系。因此,包膜糖蛋白普遍认为是疫苗研究的靶标。2
埃博拉病毒的包膜糖蛋白包膜糖蛋白是埃博拉病毒包膜唯一的表面蛋白,具有2个阅读框,分别编码1个分泌型的小蛋白sGP(secreted GP)和1个全长的跨膜GP。sGP作为GP的早期产物被大量表达,以同型二聚体形式存在,包含C53-C53′和C306-C306′两个二硫键,并且有6个N-连接糖基化位点,但只有5个始终保持糖基化;sGP可能与干扰免疫细胞对病毒的杀伤作用有关,然后再通过RNA编辑或框架漂移方式合成GP。全长GP位于病毒颗粒表面,为Ⅰ型跨膜蛋白,由GP1和GP2两个亚单位形成三角裂杯状的同源三聚体,并且高度糖基化,GP1在病毒和受体识别中发挥重要作用,而GP2主要介导病毒和包膜的融合。EBOV-GP可以通过多种摄取途径结合侵入细胞,如网格蛋白介导的内吞作用、小胞/脂筏介导的内吞作用和胞饮途径。3




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国