定义
酰基载体蛋白(acyl carrier protein,ACP)是分子量9X103-10X 103的可溶酸性蛋白质,其辅基为4'- 酸泛酰巯基乙胺。 4'- 酸端与ACP中丝氨酸残基借矶酸酯键相连,另一端的-SH自由基与脂酰基间形成硫酯键,借以携带合成的脂酰基从一个酶转移到另一个酶参加反应。在大分子长链合成过程中接受起始单元,形成起始单元-ACP复合体,再转移到需要被延伸的大分子长链上。 ACP在聚酮链的合成过程中起承载酰基单元的作用。1
作用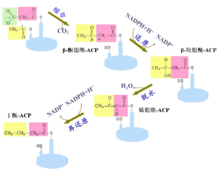 酰基载体蛋白是脂肪酸合成中的关键蛋白质,位于脂肪酸合成酶系的中央,作为脂酰基的载体将脂酰基从一个酶反应转移到另一个酶反应。ACP 不仅参与脂肪酸合成,还参与甲羟戊酸合成及脂肪酸的不饱和反应。植物贮藏脂肪酸中不饱和脂肪酸的含量、组成以及它们在总脂肪酸中所占比例,与 ACP 异构体的种类及差异表达有密切关系。因此,酰基载体蛋白是高等植物脂肪酸生物合成的一个重要辅助因子。2
酰基载体蛋白是脂肪酸合成中的关键蛋白质,位于脂肪酸合成酶系的中央,作为脂酰基的载体将脂酰基从一个酶反应转移到另一个酶反应。ACP 不仅参与脂肪酸合成,还参与甲羟戊酸合成及脂肪酸的不饱和反应。植物贮藏脂肪酸中不饱和脂肪酸的含量、组成以及它们在总脂肪酸中所占比例,与 ACP 异构体的种类及差异表达有密切关系。因此,酰基载体蛋白是高等植物脂肪酸生物合成的一个重要辅助因子。2
异构体绝大多数植物都具有几种ACP异构体。它们或是组成型表达的,或是组织特异性表达的。有科学家指出拟南芥至少具有5种质体型ACP和1种线粒体型ACP。其中ACP1在叶、根、种子中表达,但在种子中的表达远比在叶中和根中强,ACP2和ACP3在所有的组织中都表达,即属于组成型表达的。ACP4主要存在于叶片中,而ACP5仅在种子中发现,但至今尚未鉴定。其它植物如菠菜、蓖麻、大豆、大麦、油菜及萼距花中也观察到多个异构体参与质体内脂肪酸合成,部分异构体也获得鉴定。尽管ACP在脂肪酸生物合成中的重要作用已较为明确,但植物体中为何需要多种异构体,不同异构体的作用是否相同,这些问题尚未揭示。关于这个问题最合理普遍的推测是与ACP的组织特异性甚至器官特异性活性有关,例如Song and Allen分离获得了一个棉花纤维特异性的ACP,它参与了纤维伸长过程中膜脂的生物合成。而在有些组织中多种ACP同时表达,可能是不同ACP异构体具有不同的组织和发育表达模式,通过这种表达模式调控植物体内维持基本膜脂生物合成和作为三酰基甘油贮藏脂肪酸生物合成之间的平衡。2
基因表达 随着分子生物学和基因组学研究的不断深入,有关植物不同 ACP 功能分析的研究取得了一定进展。拟南芥 ACP1 是种子中优先表达的 ACP 基因。Branen 等人构建了 35S 启动子驱动的带有 ACP1 和其上游 400bp 序列的植物表达载体,转基因的拟南芥植株在叶组织中该基因的表达增加了 3-8 倍,而在种子中没有明显变化。若 ACP1 转录起始位点上游 400+-bp 区域或 CaMV 35S 启动子删除后,转基因的拟南芥植株 ACP1 蛋白的表达量不增加。因此,ACP1 的过量表达可能是 CaMV 35S 启动子的增强子元件与 ACP1 400+-bp 启动子区域相互作用的结果。在表达增强的同时,叶组织中脂肪酸组成也发生了变化,16:3 的脂肪酸含量明显减少,而相应的增加了亚油酸(18:3)的含量。但总脂肪酸含量没有改变。Battey 等人在转基因的烟草中表达菠菜 ACP1(在菠菜叶组织中占优势),与内源的烟草 ACPs 比较,ACP1 的表达提高了 2-3 倍,但叶片中总脂肪酸含量和脂肪酸组成都没有发生变化。这可能是由于不同的 ACP 异构体对于脂肪酸酰基链长度具有不同的偏好性。Suh 等在芫荽中鉴定了一个胚乳表达的 ACP,并通过体外实验证明该 CsACP-1 是△4-acyl-ACP 去饱和酶(催化棕榈酰基载体蛋白在△4 位脱氢形成特殊脂肪酸岩芹酸 16:1△4)所必需的。在拟南芥中反义抑制叶组织偏好的 ACP4,转基因 T2 代植株中出现不同程度的白化表型,并且这一表型与 ACP4 蛋白减少以及叶片脂肪酸含量减少共分离,同时白化的植株生长矮小,推测 ACP4 在叶绿体膜脂相关的脂肪酸合成中起重要作用。
随着分子生物学和基因组学研究的不断深入,有关植物不同 ACP 功能分析的研究取得了一定进展。拟南芥 ACP1 是种子中优先表达的 ACP 基因。Branen 等人构建了 35S 启动子驱动的带有 ACP1 和其上游 400bp 序列的植物表达载体,转基因的拟南芥植株在叶组织中该基因的表达增加了 3-8 倍,而在种子中没有明显变化。若 ACP1 转录起始位点上游 400+-bp 区域或 CaMV 35S 启动子删除后,转基因的拟南芥植株 ACP1 蛋白的表达量不增加。因此,ACP1 的过量表达可能是 CaMV 35S 启动子的增强子元件与 ACP1 400+-bp 启动子区域相互作用的结果。在表达增强的同时,叶组织中脂肪酸组成也发生了变化,16:3 的脂肪酸含量明显减少,而相应的增加了亚油酸(18:3)的含量。但总脂肪酸含量没有改变。Battey 等人在转基因的烟草中表达菠菜 ACP1(在菠菜叶组织中占优势),与内源的烟草 ACPs 比较,ACP1 的表达提高了 2-3 倍,但叶片中总脂肪酸含量和脂肪酸组成都没有发生变化。这可能是由于不同的 ACP 异构体对于脂肪酸酰基链长度具有不同的偏好性。Suh 等在芫荽中鉴定了一个胚乳表达的 ACP,并通过体外实验证明该 CsACP-1 是△4-acyl-ACP 去饱和酶(催化棕榈酰基载体蛋白在△4 位脱氢形成特殊脂肪酸岩芹酸 16:1△4)所必需的。在拟南芥中反义抑制叶组织偏好的 ACP4,转基因 T2 代植株中出现不同程度的白化表型,并且这一表型与 ACP4 蛋白减少以及叶片脂肪酸含量减少共分离,同时白化的植株生长矮小,推测 ACP4 在叶绿体膜脂相关的脂肪酸合成中起重要作用。
近几年,对 ACP 基因组 DNA 及其上游调控序列的研究取得了一定的进展。如 Suh 指出拟南芥和芫荽质体型的 ACP 异构体基因组大小有差异,但结构是相当保守的,都是由 4 个外显子和 3 个内含子组成的,并且内含子都遵守 GT-AG 的规则。对芫绥 ACP1 基因组上游序列的研究中发现多个顺式调控元件,如 2 ACGTmotifs(TACGTT),2 E-boxes(CAGATG,CATTTG),1 GCN4-like motif (CAAGTCA),4 AACA motifs(AACAAA)和 2(CA)n elements,这些元件都是种子或胚乳特异性表达所必需的。而 GUS 表达进一步实验表明:Cs-ACP1 上游-117- +76 区(包含 1个 GCN-like 基序、2 个 AACA 基序和 2 个(CA)n 元件)是该基因在种子中优先表达所必需的,而-242—118 区(包含 2 个 ACGT 基序、2 个 E-boxes 和 2 个 AACA基序)参与了该基因表达量的调控。此外,尽管不同植物或同一植物不同 ACP基因转录获得的 mRNA 5' 非编码区(5'-UTR)有很大的差异,但都存在保守的七核苷酸基序 “CTCCGCC”及 “CT-rich”区。有研究表明,“CTCCGCC”Box区和“CT-rich”区对控制 ACP 基因组织特异性表达具有重要的激活作用。例如,拟南芥 ACP1 和 ACP2 的 5'-UTRs 分别在种子和根中与该基因的表达相关。对 Enoyl-ACP 还原酶的表达研究也发现这种 5'-UTR 参与基因不同组织差异表达调控的情况,缺失 5'-UTR 中“CT-rich”保守区导致该基因在叶中的表达明显减少,而在种子和根中的表达不发生变化。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国